(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) 。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)25℃时,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),① 和 两种粒子的物质的量之和等于0.1mol。 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前 c (HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O).
混合后溶液中与c(NH4+) c(Cl-)。
(8分)如图中是电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是惰性电极。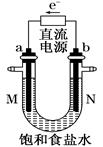
(1)a电极的名称___________________________________________。
(2)电解过程中观察到的现象_________________________________。
(3)确定N出口的气体最简单的方法是_________________________
(4)电解的总反应离子方程式为___________________________________。
(5)若将b电极换成铁作电极,写出在电解过程中U形管底部出现的现象________________________。
(10分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:_______________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_______________;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为________________。
(8分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和
20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示: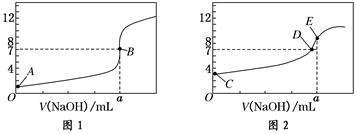
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________;
(4)E点对应离子浓度由大到小的顺序为________________。
钙、镁、铝等的化合物在生产生活中有着广泛的应用。甲、乙两研究小组分别对石灰乳吸收硝酸工业的尾气、碱式碳酸镁铝[MgaAlb(OH)c(CO3)d·xH2O]的有关问题进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得有广泛应用的Ca(NO2)2,其部分实验流程如下: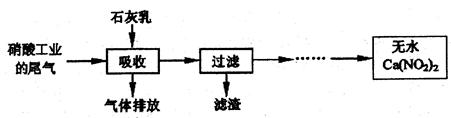
①大量氮氧化物排放到空气中,会破坏臭氧层,形成酸雨等,由氮氧化物形成的酸雨称为是_________(填“硫酸”或“硝酸”)型酸雨。过滤操作中,需要使用的玻璃仪器有烧杯、玻璃棒和_______________。
②上述流程中采用“气一液逆流接触”吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是_________________;滤渣可循环使用,滤渣的主要成分是________。
(2)乙组查阅有关资料知道碱式碳酸镁铝受热容易分解,因此在生产生活中常用作塑料阻燃剂。
①MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为______________________。
②根据你的理解,你认为碱式碳酸铝镁具有阻燃作用的可能原因主要是由于其受热分解需吸收大量热量和_______________________________。
③为确定碱式碳酸铝镁的组成,进行如下实验:准确称取6.780 g样品与足量稀盐酸充分反应,生成CO2 1.120 L(已换算成标准状况下)。另取一定量样品在空气中加热,样品的固体残留率随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物)。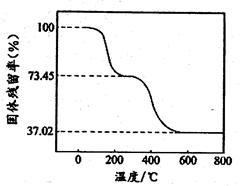
注意:固体残留率是指 。则在270℃~600℃之间,物质受热分解放出的气体是__________(填化学式)。6.780 g样品中,除结晶水外还含有的氢原子的物质的量是__________mol。
。则在270℃~600℃之间,物质受热分解放出的气体是__________(填化学式)。6.780 g样品中,除结晶水外还含有的氢原子的物质的量是__________mol。
在下图所示的一些常见单质、化合物等物质之间的转化关系中(有些反应的条件和部分物质未全部列出),已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;G是硝酸;J是无色气体,且能够使燃着的木条熄灭;A为金属单质,其氧化物具有两性;D为非金属气态单质,是大气中含量最多的物质;H为非金属固态单质,其原子核中有6个质子。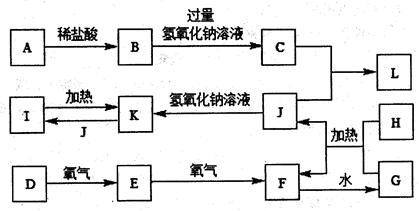
(1)化合物C的化学式为______________。
(2)物质I在生产生活中的用途有_______________(任答一条)。
(3)写出E+氧气→F的化学方程式:_________________________________________。
(4)写出A与稀盐酸反应的离子方程式:_____________________________________。