(9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
| A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。 |
| B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。 |
| C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。 |
| D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。 |
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水稀释。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为 → A→ → →D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
| 滴定序号 |
待测稀硫酸的体积(mL) |
所消耗NaOH标准溶液液的体积(mL) |
|
| V1 |
V2 |
||
| ① |
20.00 |
0.50 |
22.60 |
| ② |
20.00 |
6.00 |
27.90 |
请计算出该浓硫酸样品的浓度为 mol·L-1(不必写出计算过程)。
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是__________________。
实验Ⅱ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是______________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是___________________________________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_______________________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是_______________________________________。
实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ、Ⅱ,产生的现象完全相同。由上述实验得出的结论是______________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___________________________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
(A)乙烯是石化工业的重要原料,实验室是将和浓硫酸(体积比为)的混合液迅速加热到的方法值得的,此反应中浓硫酸的作用是和 ;乙烯在一定条件下发生加聚反应,其产物的名称是;乙烯还对水果具有功能;乙烯能在空气中燃烧,由于乙烯的,所以火焰并伴有产生。
(B)实验室制取乙烯时常因温度过高生成少量的SO2,有人设计了下列实验以确定上述混合气体中含有乙烯和SO2。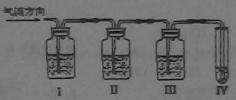
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ、Ⅱ、Ⅲ、Ⅳ。
(将下列有关试剂的序号填入空格内)
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性高锰酸钾溶液
(2)能说明SO2气体存在的现象是
(3)使用装置Ⅱ的目的是
(4)使用装置Ⅲ的目的是
(5)证明含有乙烯的现象是
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中
最大使用量为0.25
。某兴趣小组用题9图1装置(夹持装置略)收集某葡萄酒中
,并对含量碱性测定。
(1)仪器
的名称是,水通入
的进口为。
(2)
中加入300.00
葡萄酒和适量盐酸,加热使
全部逸出并与
完全反应,其化学方程式为。
(3)除去
中过量的
,然后用0.0900
标准溶液进行滴定,滴定前排气泡时,应选择题9中图2中的;若滴定终点时溶液的
=8.8,则选择的指示剂为;若用50
滴定管进行实验,当滴定管中的液面在"10"处,则管内液体的体积(填序号)(①=10
,②=40
,③<10
,④>40
)
(4)滴定至终点时,消耗
溶液25.00
,该葡萄酒中
含量为:
。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施。
葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
6
12
6(葡萄糖)+
2+
2
→
6
12
7(葡萄糖酸)+2
2
6
12
7(葡萄糖酸)+
3→
(
6
11
7)2(葡萄糖酸钙)+
2
+
2
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水 易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下:
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制
(
)2悬浊液 B.酸性
4溶液
C.
2/葡萄糖氧化酶 D.[
(
3)2]
溶液
(2)第②步充分反应后
3固体需有剩余,其目的是________;本实验中不宜用
2替代
3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:
、
、
、
、
、
、
。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:

根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. |
试样中肯定存在 、 、 和 |
| B. |
试样中一定不含 |
| C. |
试样中可能存在 、 |
| D. |
该雾霾中可能存在 、 和 |