X、Y、Z三种元素位于元素周期表的不同短周期内,X与Z属于同主族元素,Z元素的焰色反应为黄色。X单质与Y单质相互化合可以得到X2Y和X2Y2两种液体化合物,Z单质与Y单质相互化合可以得到Z2Y与 Z2Y2两种固体化合物,其中Z、Z2Y、Z2Y2都能与X2Y反应生成一种能使无色酚酞变红的ZYX溶液。
Z2Y2两种固体化合物,其中Z、Z2Y、Z2Y2都能与X2Y反应生成一种能使无色酚酞变红的ZYX溶液。
(1)试推测X、Y所代表的元素分别为X 、Y (填元素符号);
(2)写出Z单质与X2Y反应的离子方程式 ;
(3)写出Z2Y2与X2Y反应的化学方程式 。
实验室欲配制100mL 1.4mol/L的NaOH溶液,试回答:
(1)用不到的仪器是:
A烧杯 B500mL容量瓶 C天平 D胶头滴管 E玻璃棒 F100mL容量瓶
(2)配制时应称取NaOH g
(3)实验开始时,需检查容量瓶
(4)下列操作的顺序中还缺少一步操作是什么
计算冷却称量洗涤定容溶解摇匀
(5)若用1.4 mol/L的NaOH溶液润洗容量瓶,实验结果将 。溶解后立刻转移到容量瓶,结果将____________,如果容量瓶洗净后有水结果将_________。
2molSO3和3molSO2其分子数之比为_________;相同状况下(均为气体)体积之比为___________;氧原子数之比为______________。0.2 mol Al2(SO4)3中含有Al3+___________ mol、SO42-__________ mol.
写出下列盐类水解的离子方程式,并指出其溶液的酸碱性。
(1)硫酸铝溶液: (显 性)。
(2)硝酸铵溶液: (显_ 性)。
(3)次氯酸钠溶液: (显_ 性)。
(4)碳酸氢钠溶液: (显_ 性)。
某同学做如下实验,以检验反应中的能量变化。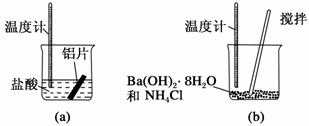
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低,由此可以判断(b)中反应是__________热反应。
(2)根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
已知Zn和Fe2O3在高温下发生反应:3Zn + Fe2O3 =" 2Fe" + 3ZnO,其中Zn是____________剂,被_______________,发生__________反应。氧化产物是_______还原产物是 ________。