某溶液中含有OH-、CO32-、SO42-三种阴离子,如果只取一次溶液分别将三种离子检验出来,那么:
(1)先检验 ,加入 试剂(或溶液)。
(2)再检验 ,加入 试剂(或溶液)。
(3)最后检验 ,加入 试剂(或溶液)。
下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。 
请按要求回答:
(1)写出B的化学式______________,G的电子式______________________。
(2)反应①的离子方程式为________________________________________。
(3)反应②进行的条件是__________________________,________________________。
(4)反应③的化学方程式为_______________________________________________。
烷烃分子中的基团—CH3、—CH2—、 、
、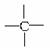 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如 
分子中,N1=6,N2=1,N3=2,N4=1。试根据不同烷烃的组成结构,分析烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子数N0与N1、N2、N3、N4之间的关系是N0=__________。
(2)四种碳原子数之间的关系为N1=__________。
(3)若分子中N2=N3=N4=1,则该分子的结构简式可能为(任写一种)__________。
(4)烷烃分子可看成由—CH3、—CH2—、 和
和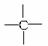 结合而成的。如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含_______个碳原子,其结构简式可能为_______或_______或_______。
结合而成的。如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含_______个碳原子,其结构简式可能为_______或_______或_______。
NO2的相对分子质量为a,NO的相对分子质量为b,则N2O的摩尔质量为()(用a、b表示)
写出下列化合物的不同类同分异构体。
(1)1-戊烯:___________(写结构简式;下同);
(2)2-甲基-1,3-丁二烯_________;
(3)乙苯:_________;
(4)2-甲基丁醛:_________;
(5)丙烯醇:_________、_________(写不同类结构简式;下同);
(6)乙酸甲酯:_________、_________;
(7)苯甲醇:_________、_________;
(8)α-氨基丙酸:_________。
烷烃分子可看成由—CH3、—CH2—、 和
和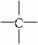 等结构组成的。如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含__________个碳原子,其结构简式可能为__________或__________或__________。
等结构组成的。如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含__________个碳原子,其结构简式可能为__________或__________或__________。