下表为元素周期表短周期的一部分
| |
|
|
|
|
| A |
B |
D |
|
|
| H |
|
|
|
|
(1)H最高价氧化物对应水化物的钠盐溶液中通入少量A的最高价氧化物会发生反应,写出相应的离子方程式 ;
(2)写出工业上制备H单质的化学方程式 ;
(3)X、Y为同周期元素,它们简单离子的电子层结构与D离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式 。
(4)与Y同周期的W元素,其原子半径是同周期主族元素中最小的。工业上制取Y和W的无水化合物方法如下:Y的氧化物与A、W的单质在高温条件下反应,每消耗6 kg A的单质,过程中转移
1×103 mol电子,写出相应反应的化学方程式 。
(5)X与B形成的化合物XB3是合成抗禽流感药物“达菲”的中间活性物质,该物质受撞击会生成一种非金属单质和一种离子化合物X3B,请写出该反应的化学方程式
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
(3)在上述五步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以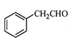 为原料制备
为原料制备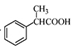 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
从薄荷油中得到一种烃A(C10H16),叫ɑ—非兰烃,与A相关反应如下:
(1)H的分子式为 。
(2)B所含官能团的名称为 。
(3)含两个—COOCH3基团的C的同分异构体共有 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 。
(4)B→D,D→E的反应类型分别为 、 。
(5)G为含六元环的化合物,写出其结构简式: 。
(6)F在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为 。
(7)写出E→F的化学方程式: 。
(8)A的结构简式为 ,A与等物质的量的Br2进行加成反应的产物共有 种(不考虑立体异构)。
某兴趣小组以苯和乙烯为主要原料,采用以下路线合成药物普鲁卡因:
已知:
(1)对于普鲁卡因,下列说法正确的是________。
| A.可与浓盐酸形成盐 | B.不与氢气发生加成反应 |
| C.可发生水解反应 | D.能形成内盐 |
(2)写出化合物B的结构简式________。
(3)写出B→C反应所需的试剂________。
(4)写出C+D→E的化学反应方程式________。
(5)写出同时符合下列条件的B的所有同分异构体的结构简式________。
①分子中含有羧基
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(6)通常采用乙烯为原料制得环氧乙烷后与X反应合成D,请用化学反应方程式表示以乙烯为原料制备X的合成路线(无机试剂任选)。
M是一种治疗直肠癌和小细胞肺癌药物的主要成分,其结构式为 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为 )。M的一条合成路线如下(部分反应试剂和条件略去)。
)。M的一条合成路线如下(部分反应试剂和条件略去)。
完成下列填空:
(1)写出反应类型。反应①_________ 反应③__________
(2)写出反应试剂和反应条件。反应②_________ 反应④__________
(3)写出结构简式。B_____________ C_____________
(4)写出一种满足下列条件的A的同分异构体的结构简式。
(a)能与FeCl3溶液发生显色反应;
(b)能发生银镜反应;
(c)分子中有5种不同化学环境的氢原子。
(5)丁烷氯代可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。
(合成路线常用的表示方法为:A B……
B…… 目标产物)
目标产物)
(6)已知:R-CO-NHR′与R-CO-OR′的化学性质相似。
从反应④可得出的结论是:_______________________。
3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: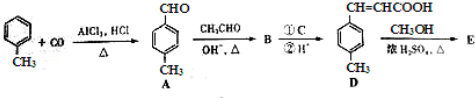
已知:HCHO+CH3CHO CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有_________ 种,B中含氧官能团的名称为_________ .
(2)试剂C可选用下列中的_________ .
a、溴水
b、银氨溶液
c、酸性KMnO4溶液
d、新制Cu(OH)2悬浊液
(3) 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_________ .
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为_________ .
(4)E在一定条件下可以生成高聚物F,F的结构简式为_________ .