(1)科学家根据体系存在着力图使自身能量趋于 和由 变为 的自然现象,提出了互相关联的 判据和 判据,为最终解决“反应进行的方向”这一问题提供了必要的依据。
(2)在密闭条件下,体系有有序自发地转变为无序的倾向,因为与有序体系相比,无序体系更加稳定,科学家把这种因素称作 。
(3)判断下列过程熵变的正负(填“>0”或“<0”):
①溶解少量蔗糖于水中,ΔS ;
②纯碳和氧气反应生成CO(g),ΔS ;
③液态水蒸发变成水蒸气,ΔS ;
④CaCO3(s)加热分解生成CaO(s)和CO2(g),ΔS 。
商品名称为“敌稗”的有机物F是一种优良的水稻除草剂,现通过下列合成路线制备: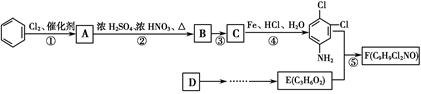
已知:Ⅰ. 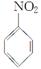
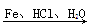
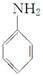 (呈碱性)
(呈碱性)
Ⅱ.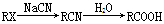
Ⅲ.苯环上原有取代基对苯环上新引入的取代基的位置有一定影响,使新的取代基进入它的邻位、对位的取代基有:—CH3、—NH2、—X(卤素原子);使新的取代基进入它的间位的取代基有:—COOH、—NO2等。
请回答:
(1)F的结构简式为________。
(2)反应②的化学方程式为______________。
(3)有人认为若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的。请你指出不妥之处_______________________________________________。
(4)绿色化学追求充分利用原料中原子,实现零排放或少排放。就该流程而言,为了实现这一点,我们该做的是_________________________________________________________。
(5)若原料D为乙烯,根据提供的信息,设计D→E(C3H6O2)的合成路线。
合成反应流程图表示方法: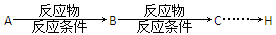
化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成: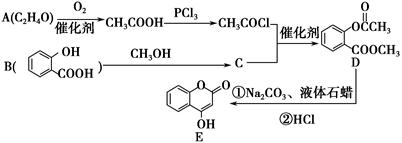
(1)A中含有的官能团名称为________。
(2)C转化为D的反应类型是________。
(3)写出D与足量NaOH溶液完全反应的化学方程式:____________________。
(4)1 mol E最多可与________mol H2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:____________。
A.能发生银镜反应
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1 mol可消耗3 mol NaOH
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯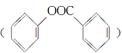 是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
是一种重要的有机合成中间体。试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
合成路线流程图示例如下: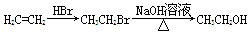
共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物,常用于有机合成,例如: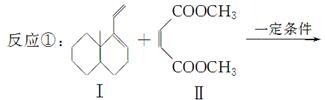
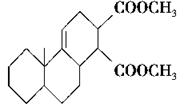
化合物Ⅱ可发生以下反应:
Ⅱ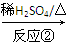 Ⅲ(分子式为C4H4O4)
Ⅲ(分子式为C4H4O4) 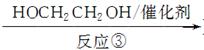 Ⅳ(高分子化合物)
Ⅳ(高分子化合物)
(1)化合物I的分子式为________,1 mol该物质完全燃烧需消耗________mol O2。
(2)反应②的化学方程式为__________________________________________。
(3)反应③是缩聚反应,化合物Ⅳ的结构简式为________。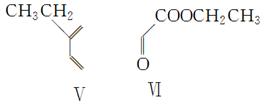
(4)在一定条件下,化合物Ⅴ和化合物Ⅵ能发生类似反应①的反应,生成两种化合物(互为同分异构体),这两种化合物的结构简式分别为________、________。
(5)下列关于化合物Ⅰ、Ⅱ、Ⅴ、Ⅵ的说法正确的有________(填字母)。
| A.Ⅰ属于芳香烃 |
| B.Ⅰ、Ⅱ、Ⅴ均能使溴的四氯化碳溶液褪色 |
| C.Ⅴ与足量H2加成后的产物是3-甲基戊烷 |
| D.加热条件下Ⅵ能与新制Cu(OH)2反应生成红色沉淀 |
聚邻苯二甲酸二烯丙酯(DAP-A)是一种优良的热固性树脂,这种材料可以采取下列路线合成: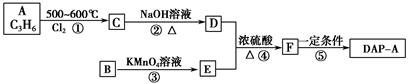
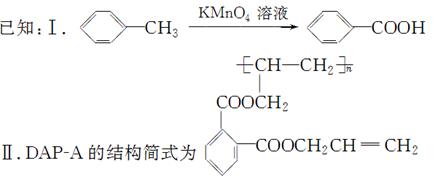
(1)反应①~④中,属于取代反应的是________。
(2)写出有关反应的化学方程式:
反应②___________________________________________________________;
反应④___________________________________________________________。
(3)G是E的同分异构体,G具有如下性质:①能发生银镜反应,且1 mol G与银氨溶液反应时最多可得到4 mol Ag;②遇FeCl3溶液呈紫色;③在稀硫酸中能发生水解反应。
则符合上述条件的G最多有________种,这些不同结构的物质,它们的核磁共振氢谱峰的数目有何特点?_______________________________________________________。
(4)工业上可由C经过两步反应制得甘油,试仿照题目中合成流程图的形式,写出这一合成过程:____________________________________________________________________。
过渡金属催化的新型碳-碳偶联反应是近年来有机合成的研究热点之一,如:
反应①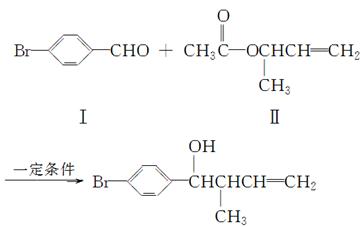
化合物Ⅱ可由化合物Ⅲ合成:
C4H7Br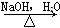 CH3CHCHOHCH2
CH3CHCHOHCH2
Ⅲ Ⅳ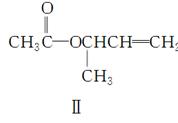
(1)化合物Ⅰ的分子式为________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为________。
(3)化合物Ⅲ的结构简式为________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为____________________________(注明反应条件)。因此,在碱性条件下,由Ⅳ与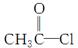 反应合成Ⅱ,其反应类型为________。
反应合成Ⅱ,其反应类型为________。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应。Ⅴ与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为________(写出其中一种)。