写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)__________________________________
(2)碳酸钠溶液与盐酸混合________________________________________
(3)硫酸铜溶液和氢氧化钡溶液混合_____________________________________
(4)向足量澄清石灰水中通入二氧化碳_______________________________________
.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 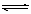 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01. |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=。已知:K300℃>K350℃,则该反应是热反应。
(2)右图中表示NO2的变化的曲线是。用O2表示从0~2s内该反应的平均速率v=。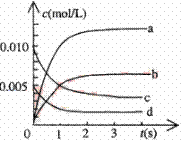
(3)能说明该反应已达到平衡状态的是。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正 (O2)d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
已知下列两个热化学方程式:
H2(g)+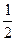 O2(g)====H2O(l)△H=-128.5kJ·mol-1
O2(g)====H2O(l)△H=-128.5kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
(1)实验测得H2和C3 H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3 H8的体积比是;
(2)已知:H2O(l) H2O(g)△H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式。
H2O(g)△H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式。
下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据: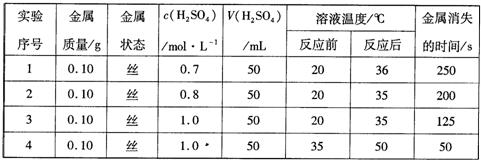
分析上述数据,回答下列问题:
(1)该金属与稀硫酸进行的反应属于
| A.放热反应 | B.复分解反应 | C.氧化还原反应 | D.离子反应 E. 置换反应 |
(2)实验1、2可得出的结论是;实验3、4可得出的结论是。
(3)如果将实验用的金属丝先浸入硫酸铜溶液一段时间后,再取出进行上述实验4,则反应需要的时间应(填“>”或“<”)50s,你认为比较合理的解释是:。
(4)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡。该金属的金属活动性比铁(选填“强”或“弱”),铁在该原电池中作极。
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。D是一种日常生活中常用的调味品。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(1)工业上,由石油获得石蜡油的方法是;
(2)丁烷是由石蜡油获得A过程中的中间产物之一,它的一种同分异构体中含有三个甲基,写出这种同分异构体的结构简式:;
(3)B、D分子中官能团的名称分别是、;
A→B的反应类型是;
写出反应B→C的化学方程式: ;
(4)大多数的有机反应速率比较缓慢,我们在实验或生产中为了提高有机反应的速率,通常采取的措施有(填一项即可)。
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。请回答下列问题: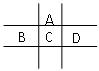
(1)B元素在周期表中的位置为;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是,最后阶段反应的离子方程式为 ;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示)。