工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 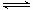 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 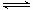 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 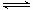 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为__________ _ 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是
__________(填字母代号)。
A高温高压 B加入催化剂 C减少CO2的浓度
D增加CO的浓度 E.分离出二甲醚
(3)已知反应②2CH3OH(g)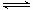 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”);达到平衡后,CH3OCH3的物质的量浓度是_____ 。
A、B、C、D、E为五种短周期元素。A、B、C是原子序数递增的同周期元素,且最外层电子数之和为15,A与C可形成常见的AC2分子;D元素的某种原子中无中子;E是地壳中含量最高的金属元素。请回答下列问题:
(1)AC2分子的电子式为____________________。
(2)比较BD3与D2C的稳定性:_______比________稳定(填化学式)。
(3)五种元素的原子半径由大到小的顺序是__________________(填元素符号)。
(4)E的单质与NaOH溶液反应生成的盐的溶液与少量AC2反应的离子方程式为___________________。
(5)化合物EB溶于强碱生成氨气,写出EB与NaOH溶液反应的化学方程式______________________。
(6)工业生产的EB产品往往含有碳和氧化铝杂质,现取10 g样品置于反应器中,通入2.016L(标准状况下)O2,在高温下充分反应后,所得气体的密度是相同状况下氢气的15倍(EB不与O2反应)。该样品中含杂质碳的质量分数为______________。
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)S的原子结构示意图为。
(2)14C可用于古代文物年代鉴定,其原子核内的中子数为_______________。
(3)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示________________________。
(4)粉末状的Si3N4对空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在一定条件下的密闭容器中热处理,可以得到对空气、水、和酸都相当稳定的固体材料,同时还可生成对水不稳定的Mg3N2,热处理后除去MgO和Mg3N2的方法是。
(5)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。若沉淀质量为7.8g,则合金的质量为______________g。
(6)将由NO和NO2组成的混合气体通入如图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2)。
已知:(i)浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。
(ii)NaOH溶液与NO2能发生反应生成两种盐和水,NaOH溶液与NO不反应。
a.装置②、③、④中盛放的药品依次是_________、、。
b.能够说明实验已成功的现象是____。
(16分)海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
NA+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
SO42- |
HCO3- |
| 含量/mg﹒L-1 |
9360 |
83 |
200 |
1100 |
16000 |
1200 |
118 |
(1)海水显弱碱性的原因是(用离子方程式表示),该海水中Ca2+的物质的量浓度为mol/L。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。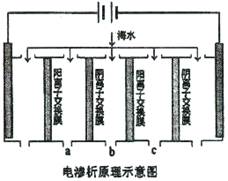
①阴极的电极反应式为。
②电解一段时间,阴极区会产生水垢.其成分为CaO3和Mg(OH)2,写出生成CaO3的离子方程式。
③淡水的出口为a、b、c中的出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示: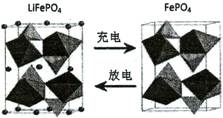
该电池电解质为能传导Li+的固体材料。放电时该电极是电池的极(填“正”或“负”),电极反应式为。
(4)利用海洋资源可获得MnO2 MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程消耗相同条件下空气和氯气的体积比为(空气中氧气的体积分数20%计算)。
(12分)目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49kJ/mol。现进行如下实验:在体积为2 L的密闭容器中,充入2molCO2和6molH2,在一定温度下发生反应并达平衡,实验中测得CO2和CH3OH(g)的浓度随时间变化如图:
CH3OH(g)+H2O(g)△H=-49kJ/mol。现进行如下实验:在体积为2 L的密闭容器中,充入2molCO2和6molH2,在一定温度下发生反应并达平衡,实验中测得CO2和CH3OH(g)的浓度随时间变化如图:
(1)从反应开始到平衡,CO2的平均速率为;
(2)下列说法中正确的是;
A、某时刻时混合气体的密度、平均相对分子质量不变均可说明该反应达平衡状态
B、单位时间内消耗3mol H2的同时消耗1 mol CH3OH,可说明该反应达平衡状态
C、反应达平衡时H2的转化率为75%
D、2 mol CO2和6 mol H2反应达到平衡时放出98.0KJ热量
E、达平衡之后改变条件若平衡发生移动。该反应的平衡常数一定改变
(3)下列措施中既能加快该反应速率又能使CO2的转化率增大的是(填字母代号);
A、加入催化剂 B、升高温度 C、恒温恒容下充入He(g) D、再充入l mol CO2和3 mol H2
(4)该温度下的平衡常数为(用分数表示);
(5)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2 (g)+3H2 (g);△H=+49.0kJ/mol
②CH3OH(g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H="-192.9" kJ/ mol
由此可推知:CH3OH(l)+1/2O2 (g)=CO2 (g)+2H2 (g)的△H-192.9 KJ/mol(填“>”“<”或“=”);又已知:H2O(g)= H2O (l);△H=-44.0 KJ/mol,则CH3OH(g)的燃烧热为。
(18分)短周期主族元素A、B、C、D、E、F的原子序数依次增大。A的原子半径最小,E是地壳中含量最多的金属元素。C、F同主族,且C原子的最外层电子数是内层电子数的3倍,D原子的核电荷数是B原子的质子数的2倍。请用化学用语回答下列问题:
(1)单质D可在化合物甲中燃烧得单质B和化合物乙。B在周期表中的位置为,化合物甲的电子式为。化合物乙属于晶体(填晶体类型)。
(2)B、F形成的一种化合物BF2是一种有恶臭的液体,将它滴入硫酸酸化的高锰酸钾溶液中,会有黄色物质析出并放出一种无色无味的气体。写出该反应的离子方程式。当产生的气体为0.5 mol时,该反应转移的电子数为。
(3)化合物X、Y、Z依次是B、E、F三种元素最高价含氧酸的钠盐。X、Y溶液均呈碱性,Z溶液pH<7。
①Z的化学式为。
②Y、Z两溶液混合反应可得到澄清的溶液,该反应的离子方程式为;向该溶液中加入X溶液,会产生白色沉淀和无色气体,请写出发生的反应的离子方程式。
(4)由A、B、C三种元素组成的物质X,其摩尔质量为60g/mol,已知x2 2x,其中X2为X的二聚物,经实验测得不同压强下,体系的平均相对分子质量
2x,其中X2为X的二聚物,经实验测得不同压强下,体系的平均相对分子质量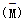 其中随温度T的变化曲线如图所示,
其中随温度T的变化曲线如图所示,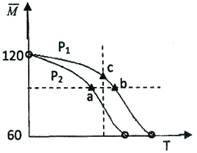
下列说法正确的是。
A.该过程的△H<0
B.平衡常数:K(a)= K(b)< K(c)
C.气体压强:P(a)< P(b)= P(c)
D.当a=80时,X2(g)与X(g)的物质的量之比为1:1