现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)已知T℃,纯水中c(H+)=1×10-6.5 mol·L-1,则T℃ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
现有下列九种物质:①蔗糖(C12H22O11)、②熔融NaCl、③NaCl溶液、④铝、⑤氢氧化钡、⑥液氧(O2)、⑦硫酸铜、⑧酒精(C2H6O)、⑨H2SO4
(1)在以上物质中,属于电解质的是(填写序号)。
(2)从上述物质中选出两种物质作为反应物,写出一个符合下列反应类型的化学方程式:
①化合反应 ;
②置换反应 ;
③复分解反应;
④有非电解质参与反应的氧化还原反应。
某校化学小组的同学以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的附着物,设计了如下过程:
Ⅰ.有关资料
铜的化合物的颜色、性质如下:
| 物质 |
颜色、性质 |
物质 |
颜色、性质 |
|
| 氢氧化铜Cu(OH)2 |
蓝色固体不溶于水 |
硫酸铜(CuSO4) |
溶液呈蓝色 |
|
| 氧化亚铜(Cu2O) |
红色固体不溶于水 |
氯化铜(CuCl2) |
溶液呈绿色,稀溶液呈蓝色 |
|
| 氯化亚铜(CuCl) |
白色固体不溶于水 |
碱式氯化铜 |
绿色固体不溶于水 |
Ⅱ.探究实验
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②根据以上资料,白色物质化学式可能为。
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒附着物,洗涤、干燥,连接下列装置进行实验,验证阴极产物。
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质有无Cu2O? (填“有”或“无”),请简要说明的理由:
;
②在c装置后将气体通入硝酸银溶液中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在,写出装置b中发生反应的化学方程式: 。
(3) 由以上实验分析可知:电解CuCl2溶液的阴极上发生的电极反应式为Cu2++2e- Cu和 。
Cu和 。
在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则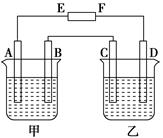
(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
(1)从NaCl、CuSO4两种电解质中选取适当的物质,按电解要求填写(填化学式):
①以铜为电极,进行电解时电解质浓度不变,则采用的电解质是__________。
②以碳棒为电极,进行电解时使电解质和水的质量均变小,则采用的电解质是________。
此电解反应的阳极反应式:,电解池的总反应化学方程式:。
(2)①甲同学用直流电源、碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)===CuSO4+H2↑,则该同学选用的阳极材料是_______。
②乙同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒上都有气泡产生,但铜棒却没有被腐蚀。请你选出最可能的原因(填字母代号)
A.铜被稀硫酸钝化 B.碳棒和铜棒与电源正负极接反
此时的电解池的总反应为________________________
“物质的组成和结构决定物质性质,物质的性质决定了物质的用途”。请分析:
(1)金刚石很硬,而石墨却很软。原因是
。
(2)氢氧化钠和氢氧化钡溶液都能使无色酚酞试液变红。原因是
。
(3)CO具有可燃性,可以做燃料;CO具有还原性,可以用来。
(答一点即可)