试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样,按下图所示进行实验: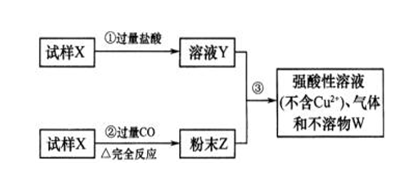
(1)写出步骤③中所发生反应的离子方程式。 ;
(2)若全部的溶液Y和全部的粉末Z充分反应,生成不溶性物W的质量为 m ,则每份试样中氧化铜的质量为(用m表示) 。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H 2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1, N2H4(g)+O2(g)="==" N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________________。
已知下列反应的焓变
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) △H1="-870.3kJ/mol"
(2)C(s)+O2(g) = =CO2(g)△H2=-393.5kJ/mol
=CO2(g)△H2=-393.5kJ/mol
(3) 2 H2(g)+O2(g) ==2H2O(l)△H3= -285.8kJ/mol 试计算反应2C(s)+2H2(g)+O2(g) ==CH3COOH(l)的焓变ΔH=
试计算反应2C(s)+2H2(g)+O2(g) ==CH3COOH(l)的焓变ΔH=
工业制氢气的一个重要反应是:CO(s)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) ==CO2(g)△H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ==CO (g)△H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)==H2O(g)△H3=-242kJ·mol-1
试计算25℃时CO(s)+ H2O(g) ="=" CO2(g) + H2(g)的反应热_______ kJ·mol-1
写出298K时,下列反应的热化学方程式
(1)28 g CO还原Fe2O3生成单质铁,放出8.3 kJ热量;
(2)N2和O2化合生成184 g NO2气体,吸收热量135.4 kJ;
某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水所含的三种离子是______、_______、_______。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填:活性炭、硫酸亚铁、硫酸亚铁、铁粉),可能回收其中的金属__________(填元素符号)
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的__________(填入离子符号)转化为沉淀。经过滤后的废水主要含_____________,可用来浇灌农田。