(10分)纯净物根据其组成和性质可进行如下分类。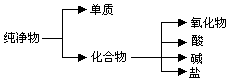
⑴上图所示的分类方法属于 (填序号)
A、交叉分类法 B、树状分类法
⑵以H、O、S、C、K、Ca六种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
|
|
|
|
⑶下列4组物质均有一种物质的类别与其他3种不同,且这四种物质相互作用可生成一种新物质——碱式碳酸铜,化学式为Cu2(OH)2CO3。
A. CaO、Na2O、CO2、CuO
B. H2、C、P、Cu
C. O2、Fe、Cu、Zn
D. HCl、H2O、H2SO4、HNO3
以上四组物质中与其他物质不同的物质依次是(填化学式)
A.________;B.________;C.________;D.________。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称________;B在周期表中的位置第______周期,第________族;
(2)A、B形成的化合物的电子式________;
(3)C的元素符号________,C的最高价氧化物的化学式________;
(4) D的最高价氧化物对应的水化物的化学式________.
(18分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为,化学性质最稳定的元素符号是,最高价氧化物的水化物的酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为、,原子半径最大的金属元素的名称是,离子半径最小的离子结构示意图是。
(16分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
| h |
|||||||||||||||||
| a |
c |
f |
i |
m |
|||||||||||||
| e |
g |
k |
|||||||||||||||
| d |
(1)表中所列元素中,属于短周期元素的有(写元素符号),
e元素在元素周期表中的位置是周期,族。
(2)下列组元素的单质可能都是电的良导体。
A、a, c, h B 、 i ,g, k C、c, h, m D、 d, e, f
(3)i元素属于(填金属或非金属)元素,它的最高正化合价是
负化合价是。它能跟氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出它跟氧气反应的化学方程式:。
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。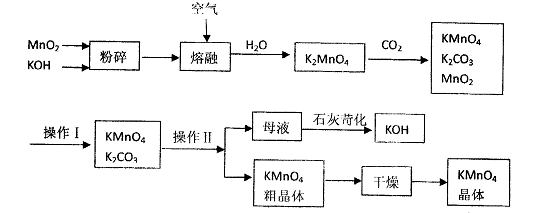
(1)上述流程中可以循环使用的物质有、(写化学式)。
(2)若不考虑制备过程中的损失与物质循环,则1 mol MnO2可制得mol KMnO4;反应中二氧化锰的主要作用是(“氧化剂”、 “还原剂”、“催化剂”)。
(3)操作I的名称是;操作Ⅱ根据KMnO4和K2CO3两物质在(填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(4)写出母液中加入生石灰苛化时的反应总的离了方程式.
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)。
| A.石灰石 | B.稀HC1 | C.稀H2SO4 | D.纯碱 |
所需气体发生装置是(选填序号)。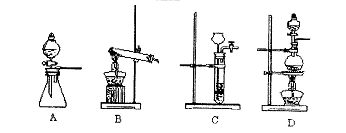
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与N 具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
(1)Y在周期表中的位置是。
(2)用电子式表示化合物X3W的结
构 。
(3) X3W遇水可释放出使酚酞溶液变红的气体A,该
反应的化学方程式是。
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则ab(填“>”或“<”或“=”)。
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是。
(6)已知W的单质与气体B在一定条件下可形成气体A,即:
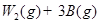
 △H=—92.4kJ·mo1-1
△H=—92.4kJ·mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mo1/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10 min |
3.8 |
8.4 |
0.4 |
| 第20 min |
3.4 |
7.2 |
1.2 |
| 第30 min |
3.4 |
7.2 |
1.2 |
| 第40 min |
3.6 |
7.8 |
0.8 |
0min~10min, W2 的平均反应速率。
②反应在第l0min改变了反应条件,改变的条件可能是。
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是。
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度