Ⅰ某化学过程的示意图如图所示。在装置工作过程中,甲池的总反应式为: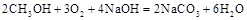 。试回答下列问题:
。试回答下列问题: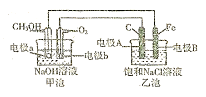
(1)甲池溶液中的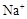 移向 (填“a”或“b”)电极,
移向 (填“a”或“b”)电极,
乙池溶液中的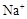 移向 (填“ A”或“B”)电极;
移向 (填“ A”或“B”)电极;
(2)电极a上发生的电极反应式为 ;
(3)乙池中发生反应的离子方程式为 ;
(4)当电极A处得到0.71g产物时,甲池中理论上消耗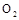
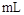 (标准状况下)。如何检验A处的产物 。
(标准状况下)。如何检验A处的产物 。
Ⅱ某研究性学习小组对铝热反应实验展开研究。现行高中化学教材对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,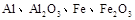 熔点、沸点数据如下:
熔点、沸点数据如下:
| 物质 |
Al |
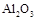 |
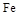 |
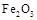 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理 (填“合理”或“不合理”)
用一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂 ,反应的离子方程式为 。
实验室溶解该熔融物,下列试剂中最适宜的试剂是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D. 氢氧化钠溶液
工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 |
T/℃ |
起始浓度/mol•L-1 |
等质量催化剂的 比表面积/m2•g-1 |
|
| CO |
H2 |
|||
| ① |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| ② |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
| ③ |
350 |
124 |
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈____性(“酸”、“碱”、“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
____Cr(OH)3+____Na2CO3+_____  = ____Na2CrO4+___CO2+_____
= ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、___________________________________。
(4)“系列操作”中为:继续加入H2SO4,________冷却结晶,过滤。继续加入H2SO4目的是________________________。
已知:①除去滤渣II后,溶液中存在如下反应:2CrO42ˉ+2H+ Cr2O72ˉ+H2O
Cr2O72ˉ+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 化学式 |
20℃ |
60℃ |
100℃ |
| Na2SO4 |
19.5 |
45.3 |
42.5 |
| Na2Cr2O7 |
183 |
269 |
415 |
| Na2CrO4 |
84 |
115 |
126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式____________________________。
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下: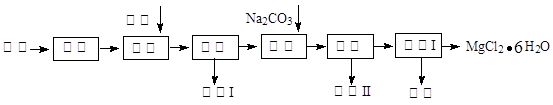
已知:25℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
BaCO3 |
Mg(OH)2 |
Fe (OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
5.1×10-9 |
5.61×10-12 |
2.64×10-38 |
回答下列问题:
(1)写出溶解时的离子方程式
(2)溶解时温度不能太高,也不宜太低,要求控制在35℃左右,其理由是
(3)操作I包含多个操作,分别为过滤,洗涤,烘干。烘干时需要减压烘干,原因是。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在离子,选择检验该离子的原因是。
(5)母液的主要成分。
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。
已知:I.
Ti(s)+O2(g)=TiO2(s)△H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g)△H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g)△H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 |
TiCl4 |
FeCl3 |
SiCl4 |
AlCl3 |
| 沸点/℃ |
136 |
310 |
56.5 |
180 |
回答下列问题:
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g) 。试计算其反应的△H=kJ•mol-1;反应的平衡常数表达式K=,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO(g) 。试计算其反应的△H=kJ•mol-1;反应的平衡常数表达式K=,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g)△H=+151kJ•mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ•mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
(4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式:。
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图: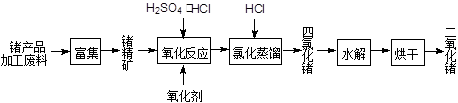
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、、、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为。
温度对GeCl4的水解率产生的影响如图1所示,其原因是。 为控制最佳的反应温度,实验时可采取的措施为(填序号)。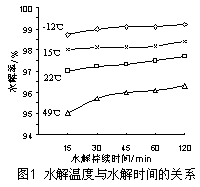
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应。
| pH |
4 |
5 |
6 |
7 |
8 |
9 |
| 溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |