(9分)如图是某同学设计的放热反应的观察装置。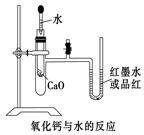
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管 螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:(1)实验中观察到的现象是
(2)该实验中必须进行的一步实验操作是
(3)该实验的原理是
________________________________________________________________________
(4)实验中反应的化学反应方程式是
(5)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?____。
(10 分)结合下列实验装置图回答问题: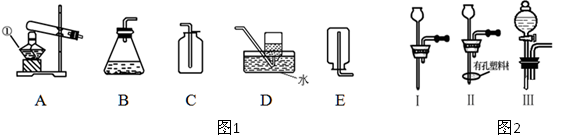
(1)某课外活动小组的同学用图1装置探究CO2的实验室制法:
①甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是,收集装置是。
②加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 Na2CO3 + H2O +CO2↑
Na2CO3 + H2O +CO2↑
NH4HCO3 NH3 ↑+ H2O +CO2↑
NH3 ↑+ H2O +CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是。
他不选用碳酸氢铵制取CO2的理由是。
(2)图1中装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
(10分)为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。
| 葡萄糖注射液 |
| 规格:250mL(密度:1.08g·mL-1) 生产批号:1003203 2 有效期:至2013年10月 5% |
实验用品:葡萄糖固体、蒸馏水、烧杯、容量瓶(500 mL)、药匙、胶头滴管、量筒。
(1)还缺少的仪器有 。
(2)下列对容量瓶及使用的描述中不正确的是 。
A.容量瓶上标有容积、温度和浓度
B.使用前要检查容量瓶是否漏水
C.容量瓶用蒸馏水洗净后,再用5%葡萄糖注射液洗
D.配制溶液时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
(3)实验中需取用固体的质量为 g,该葡萄糖注射液的物质的量浓度 mol/L.。
(4)配制该葡萄糖注射液,下列操作会导致所配溶液的物质的量浓度偏高的是 。
A.没有将洗涤液转移到容量瓶 B.定容时俯视刻度线
C.容量瓶洗净后未干燥 D.定容时液面超过了刻度线
(6分)如图为实验室制取蒸馏水的装置示意图,根据下图回答下列问题。
(1)指出图中的两处明显的错误:
_____________________________;_____________________________ 。
(2)水在a中(填仪器的名称,下同)由液态变为气态,在b中由气态变为液态。
(3)实验时A中除加入少量自来水外,还需加入少量_____________,其作用是________________________________ 。
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
(1)制备一氧化碳的化学方程式是;
(2)试验中,观察到反应管中发生的现象时;
尾气的主要成分是;
(3)反应完成后,正确的操作顺序为(填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节);
②写出有关反映的化学方程式。
用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解④转移、洗涤⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是。
(从下列中选用 A. 10ml B. 25ml C. 50ml D. 100ml)
(2)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面