氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,
性质稳定,请回答: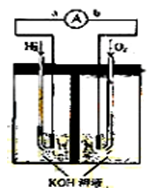
 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为  (用a、b 表示)。
(用a、b 表示)。 (2)负极反应式为 。
(2)负极反应式为 。 (3)电极表面镀铂粉的原因为 。
(3)电极表面镀铂粉的原因为 。 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ2Li+H2
Ⅰ2Li+H2 2LIH
2LIH Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑ ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。 ②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
X.Y.Z代表原子序数依次增大的三种短周期元素,在周期表中三种元素的位置相邻,且质子数之和为30。
(1)X.Y.Z三种元素能否位于同一族(填“能”或“否”),
理由是。
(2)若X.Y.Z三种元素中有金属元素,则X是(填元素符号),而Z与过量NaOH溶液反应的离子方程式为。
(3)若X.Y.Z均为主族非金属元素,由X和Y组成的化合物 A中,X和Y元素的质量比为7:16,则A可以为色的(填化学式)。
A中,X和Y元素的质量比为7:16,则A可以为色的(填化学式)。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。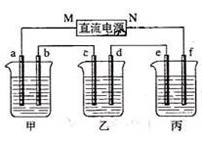
⑴、接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①、电源的N端为▲极;
②、电极b上发生的电极反应为▲;
③、列式计算电极b上生成的气体在标准状况下的体积为▲;
④、电极c的质量变化是▲g;
⑤、电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液▲;乙溶液▲;丙溶液▲。
⑵、如果电解过程中铜全部析出,此时电解▲(填“能”或“否”)继续进行,理由是▲。
用右图所示装置进行中和热测定实验,请回答下列问题:
⑴、大小烧杯之间填满碎泡沫塑料的作用是▲,从实验装置上看,图中缺少的一种玻璃仪器是▲。
⑵、使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热
△H= ▲, H2SO4与NaOH反应的热化学方程式 ▲。
⑶、实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 ▲(填“相等”、“不相等”),所求中和热 ▲(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ▲。(填“偏大”、“偏小”、“不受影响”)
⑷、若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH 1,则ΔH1与ΔH的关系为:ΔH 1 ▲ΔH(填“<”、“>”或“=”),理由是 ▲。
金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。 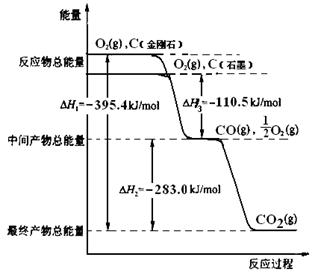
⑴、等量金刚石和石墨完全燃烧▲(填“金刚石”或“石墨”)放出热量更多,表示石墨燃烧热的热化学方程式▲。
⑵、在通常状况下,金刚石和石墨▲(填“金刚石”或“石墨”)更稳定,写出石
墨转化为金刚石的热化学方程式▲。
⑶、12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量▲。
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。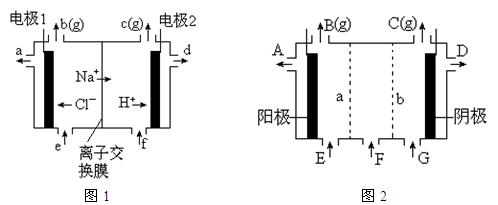
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为▲,▲。
⑵、如果粗盐中SO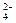 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是▲。
,该钡试剂可以是▲。
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为▲。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从▲口流出,b口排出的是▲气体,电极1应连接电源的
▲极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是▲。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为▲(填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是▲。
③、从D、E口流出或流进的物质的化学式分别为▲,▲。