海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
| Cl- |
18980 |
Ca2+ |
400 |
| Na+ |
10560 |
HCO3- |
142 |
| SO42- |
2560 |
Br- |
64 |
| Mg2+ |
1272 |
|
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①CH4(g)+H2O(g)=CO(g) + 3H2(g)△H =+206.0 kJ·mol-1
② CO(g)+2H2(g)=CH3OH (g)△H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H=。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。
假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应②生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是(填序号):
| A.c ( H2 )减少; |
| B.平衡常数K增大; |
| C.CH3OH 的物质的量增加; |
| D.正反应速率加快,逆反应速率减慢; |
E.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用图装置模拟上述过程,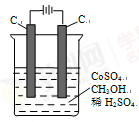
则:Co2+在阳极的电极反应式为:;除去甲醇的离子方程式为。
|
单体液晶(有机物III)是用偶联反应合成的:
反应①

 的反应条件是 。
的反应条件是 。
 与CH3I能发生类似①的反应,该反应方程式是: 。
与CH3I能发生类似①的反应,该反应方程式是: 。
(16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 |
CH4 |
CO2 |
CO |
H2 |
| 平衡浓度(mol·L-1) |
0.5 |
0.5 |
2.0 |
2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g)△H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的△H="_______" kJ·mol-1
2CO(g)+2H2(g) 的△H="_______" kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4 CH3COOH, 请回答:
CH3COOH, 请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图。
250~300℃时,温度升高而乙酸的生成速率降低的原因是____。
② 为提高上述反应CH4的转化率,可采取的措施有(写2种)。
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为,每消耗3mol Cu2Al2O4时被还原的HNO3为mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
(16分)脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
(1)Ⅱ中含氧官能团的名称.
(2)反应②的化学方程式。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式。
(4)下列说法正确的是。
| A.Ⅰ和Ⅴ均属于芳香烃 | B.Ⅱ能发生银镜反应 |
| C.Ⅱ能与4molH2发生加成反应 | D.反应③属于酯化反应 |
(5)A的结构简式。
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式。
(7) 一定条件下,化合物Ⅶ( )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式。
【化学——选修4 有机化学基础】
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
请回答下列问题:
(1)写出A在实验室制乙烯的方程式: 。
(2)B和E反应生成F的化学方程式为______ _____,该反应的类型为_____________;
(3)D的结构简式为____ _______;
(4)写出D的同分异构体(含醛基)发生银镜反应的化学方程式:
(5)C的同分异构体中含醛基的结构有 种。