某研究性学习小组利用手持技术探究强碱和不同的酸中和反应的过程如下:
(1)实验步骤:
①分别配制浓度均为0.1mol·L-1的NaOH、HC1、CH3 C00H、H3PO4溶液备用。配制过程中用到的玻璃仪器有烧杯、容量瓶、玻璃棒、细口瓶、____、____。
②在锥形瓶中加入10mL0.1 mol.L-1的HC1,在25.00mL____(填“酸式”、“碱式”)滴定管中加入0.1 mol.L-1的NaOH,连接数据采集器和pH传感器。
③向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④存储计算机绘制的pH变化图。用0.1 mol·L-1的CH3 C00H、H3 P04溶液代替HC1重复上述②~④的操作。
(2)结果分析:20℃时NaOH分别滴定HC1、CH3 C00H、H3 P04的pH变化曲线如下。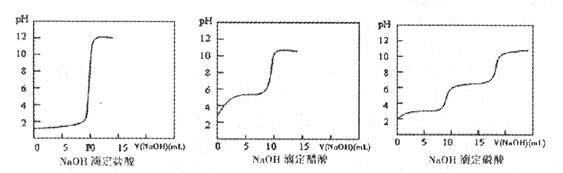
根据上述曲线回答下列问题:
①20℃时,三种酸从强到弱的顺序是 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
③醋酸恰好中和时pH≈8的原因是 ;
④你认为前述的步骤中,NaOH滴定磷酸是否可行? (填“可行”、“不可行”)。
利用化石燃料开采、加工过程产生的
废气制取氢气,既廉价又环保。
(1)工业上可用组成为
的无机材料纯化制取的氢气
①已知元素
、
均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则
的原子结构示意图为
②常温下,不能与
单质发生反应的是(填序号)
a. 溶液 b. c.浓硫酸 d. e. 固体
(2)利用
废气制取氢气来的方法有多种
①高温热分解法
已知:
在恒温密闭容器中,控制不同温度进行
分解实验。以
起始浓度均为
测定
的转化率,结果见右图。图中a为
的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的转化率。据图计算985℃时
按上述反应分解的平衡常数
=_;说明温度的升高,曲线b向曲线a逼近的原因:

 ②电化学法
②电化学法
该法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是;反应池中发生反应的化学方程式为。反应后的溶液进入电解池,电解总反应的离子方程式为_。
芳香化合物
是一种基本化工原料,可以从煤和石油中得到。
是一种重要的有机化工中间体。
和
的转化关系如下所示:
回答下列问题:
(1)
的化学名称是;
(2)由
生成
的反应类型是。在该反应的副产物中,与
互为同分异构体的化合物的结构简式为;
(3)写出
所有可能的结构简式;
(4)
(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成
。用化学方程式表示合成路线;
(5)
的化学名称是,
经中间体
可合成一种聚酯类高分子化合物
,由
合成
的反应类型为,该反应的化学方程式为。(提示 )
)
(6)芳香化合物
是
的同分异构体,
分子中含有醛基、酯基和醚基三种含氧官能团,写出
所有可能的结构简式。
铝是一种应用广泛的金属,工业上用
和冰晶石(
)混合熔融电解制得。
①铝土矿的主要成分是
和
等。从铝土矿中提炼
的流程如下:
②以萤石(
)和纯碱为原料制备冰晶石的流程如下: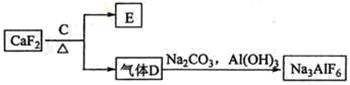
回答下列问题:
(1)写出反应1的化学方程式;
(2)滤液Ⅰ中加入
生成的沉淀是,反应2的离子方程式为;
(3)
可作为建筑材料,化合物
是,写出由
制备冰晶石的化学方程式;
(4)电解制铝的化学方程式是,以石墨为电极,阳极产生的混合气体的成分是。
用含有
、
和少量
的铝灰制备
。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀
,过滤:
Ⅱ.向滤液中加入过量
溶液,调节溶液的
约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入
至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)
溶解
的离子方程式是
(2)
氧化
的离子方程式补充完整:

(3)已知:
生成氢氧化物沉淀的
|
|
|
|
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1
根据表中数据解释步骤Ⅱ的目的:
(4)己知:一定条件下,
可与
反应生成
,
① 向 Ⅲ 的沉淀中加入浓
并加热,能说明沉淀中存在
的现象是.
②Ⅳ 中加入
的目的是
是汽车尾气中的主要污染物之一。
(1)
能形成酸雨,写出
转化为
的化学方程式:.
(2)汽车发动机工作时会引发
和
反应,其能量变化示意图如下:
①写出该反应的热化学方程式:.
②随温度升高,该反应化学平衡常数的变化趋势是。
(3)在汽车尾气系统中装置催化转化器,可有效降低
的排放。
①当尾气中空气不足时,
在催化转化器中被还原成
排出。写出
被
还原的化学方程式:.
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收
生成盐。其吸收能力顺序如下:
.原因是.
(4)通过
传感器可监测
的含量,其工作原理示意图如下:
①
电极上发生的是反应(填"氧化"或"还原")。
②写出
电极的电极反应式: .