日常生活中常见的金属材料有铝合金、钢铁等,某化学实验小组欲测定几种金属材料的耐腐蚀性,所用药品和试剂有:铝合金、钢铁、CO2、SO2、水。
(1)请完成以下实验设计表,并在实验目的的一栏中填入对应的实验编号:
| 实验编号 |
金属材料 |
溶 液 |
实验目的 |
| ① |
铝合金 |
CO2+ H2O |
Ⅰ.探究不同溶液对金属材料的腐蚀速率; Ⅱ.探究不同金属材料的腐蚀速率; |
| ② |
|
|
|
| ③ |
|
|
(2)在10%的盐酸中温度对铝合金的腐蚀速率影响关系见下图:铝合金在40℃时的腐蚀速率是20℃的 倍.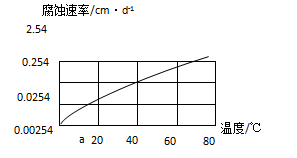
(3)请在上题图象中,画出铝合金在CO2溶液和SO2溶液中腐蚀速率随温度变化关系的预期结果示意图(都从a点开始)。
1)请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。
试剂: a.水 b.溴的CCl4溶液 c.溴水 d.NaOH溶液
分离装置:
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 |
| 混合物 |
需加入的试剂 |
分离方法 |
|
| ① |
1一氯丙烷 (乙醇) |
||
| ② |
乙烷 (乙烯) |
||
| ③ |
溴化钠溶液(碘化钠) |
||
| ④ |
苯 (苯酚) |
(2)下列实验能获得成功的是________。
①向溴乙烷中加入NaOH溶液充分反应后,取上层清液并加入AgNO3溶液可观察到有淡黄色沉淀生成。
②向苯酚溶液中加入浓溴水可观察到有白色沉淀生成
③不慎把苯酚溶液沾到了皮肤上,应立即用酒精洗涤。
④用酸性高锰酸钾溶液鉴别苯和甲苯
⑤用酸性高锰酸钾溶液鉴别己烯中是否混有少量甲苯
⑥实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
烷烃A(C6H14)结构中共有四个甲基,能生成三种一氯代产物B、C、D。
B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示(反应中生成的无机产物已略去),G分子中含有醛基(-CHO)。

请回答:
(1)写出结构简式:A;C;E。
(2)写出反应类型名称:B→F;F→E。
(3)写出F转化为G的化学方程式_________________
有以下一系列反应,终产物为乙二醛。
已知B的相对分子质量比A的大79,请回答:
(1)写出结构简式:A; E。
(2)写出B转化为C的化学方程式_________________
有机物的结构可用“键线式”简化表示
如:CH3-CH=CH-CH3可简写为 。某有机物X的键线式为
。某有机物X的键线式为 。
。
(1)有机物X的分子式为。
(2)X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有种。
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为,
该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程式。
(4)某醇W与X的相对分子质量相同,1 mol W与足量Na反应能产生标准状况下的氢气22.4 L,经测定W分子有如下特点:①一个碳原子最多连接一个官能团;②该分子不存在官能团位置异构现象。则W的结构简式为。
下表是A、B二种烃的有关信息;
| A |
B |
①能使含溴的四氯化碳溶液褪色;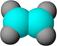 ②比例模型为: ②比例模型为:③能与水在一定条件下反应 |
①由C、H两种元素组成;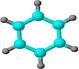 ②球棍模型为: ②球棍模型为: |
根据表中信息回答下列问题:
(1)A与含溴的四氯化碳溶液反应的生成物的名称叫做;
写出在一定条件下,A生成高分子化合物的化学反应方程式_______。
(2) A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=_________时,这类有机物开始出现同分异构体。
(3) B具有的性质是(填序号):
①无色无味液体、②有毒、③不溶于水、④密度比水大、
⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:。