能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池.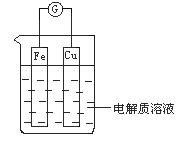
①当电解质溶液为稀硫酸时:
Cu电极是_____(填“正”或“负”)极,其电极反应为____;
②当电解质溶液为浓硝酸时:
Cu电极是_____极,其电极反应为__________。
(2)请写出电解硫酸铜溶液的总化学方程式 。
(3)燃烧氢气时耗氧量小,放出热量多。已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式为: 。
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式: 。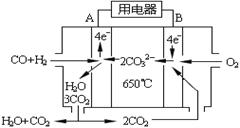
(5)请根据下面所给出的5个热化学方程式,判断反应④的反应热ΔH4是________。
①NH3(g)+HCl(g)===NH4Cl(s) ΔH1=-176 kJ·mol-1
②NH3(g)+H2O(l)===NH3·H2O(aq) ΔH2=-35.1 kJ·mol-1
③HCl(g)+H2O(l)===HCl(aq) ΔH3=-72.3 kJ·mol-1
④NH4Cl(s)+H2O(l)===NH4Cl(aq) ΔH4=?
⑤NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l) ΔH5=-52.3 kJ·mol-1
已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,
Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1.6×10-12,现用0.01 mol/L AgNO3溶液滴定0.01 mol/L KCl和0.001 mol/L K2CrO4混合溶液,通过计算回答:
(1)Cl-、CrO42-先生成沉淀的是________。
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是________mol/L。(设混合溶液在反应中体积不变)
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)  2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e- H1="+" 1175.7 kJ·mol-1
H1="+" 1175.7 kJ·mol-1 PtF6(g)+ e-1
PtF6(g)+ e-1 PtF6-(g)
PtF6-(g) H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-  H3="+482.2" kJ·mol-1
H3="+482.2" kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,
性质稳定,请回答: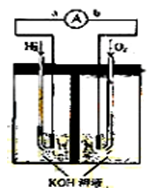
 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(用a、b 表示)。 (2)负极反应式为 。
(2)负极反应式为 。 (3)电极表面镀铂粉的原因为 。
(3)电极表面镀铂粉的原因为 。 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ2Li+H2
Ⅰ2Li+H2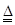 2LIH
2LIH Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑ ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。 ②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。


 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有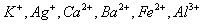 阴离子有
阴离子有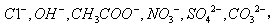 现将它们分别配成
现将它们分别配成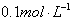 的溶液,进行如下实验:
的溶液,进行如下实验:
①
 测得溶液A、C、E呈碱性,且碱性为A>E>C;
测得溶液A、C、E呈碱性,且碱性为A>E>C;
②
 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③
 向D溶液中滴加
向D溶液中滴加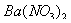 溶液,无明显现象;
溶液,无明显现象;
④
 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1)
 实验②中反应的化学方程式是
实验②中反应的化学方程式是
 ;
;
 (2)E溶液是,判断依据是
(2)E溶液是,判断依据是
 ;
;
 (3)写出下列四种化合物的化学式:A、C、
(3)写出下列四种化合物的化学式:A、C、
 D、F.
D、F.
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。 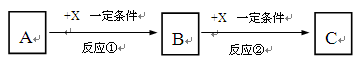
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________(填序号)
a.C b.Na c.S d.Al
(2)若X是日常生活中最常用的金属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
B的化学式为____________;反应②的化学方程式为:,
C溶液中加入NaOH溶液后产生的现象是, 方程式为。