实验室配制500ml 2mol·L-1的H2SO4溶液
(1)所需仪器应该有容量瓶、玻璃棒、量筒、________________、________________。
(2)容量瓶在使用前,首先应检查 。
(3)此实验中,玻璃棒的两个作用分别是________________、________________。
(4)配制时,要用量筒量取密度为1.84g/cm3,质量分数为98%的浓硫酸_____________ml。
(5)若配好摇匀后,发现容量瓶中的液面略低于刻度线,问是否应该补充蒸馏水_________(填“应该”或“不应该”);若所用的容量瓶中事先有少量的蒸馏水,则对实验结果有无影响____________。(填“有影响”或“无影响”)
下列有关实验的叙述,正确的是(填序号) 。
| A.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶 |
| B.用渗析法分离淀粉中混有的NaCl杂质 |
| C.无法用分液漏斗将甘油和水的混合液体分离 |
| D.用酸式滴定管量取20.00mL高锰酸钾溶液 |
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H)配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
(14分)、海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: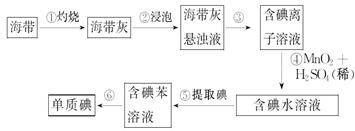
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在横线处)。______________
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 |
E.酒精灯 F.干燥器 G.坩埚钳
(2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______________。
(3)在步骤④中MnO2转变为Mn2+、I-转变为I2,请写出反应的离子方程式是___________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是___________________________________;_____________________________________________________________。
(5)、检验提取碘后的水溶液中是否还含有单质碘的试剂是:________________。
可用右图所示装置制取少量乙酸乙酯。请填空:
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是___________________________________
(2)为防止a中的液体在实验时发生暴沸,可在加热前采取的措施是__________。
(3)实验中加热试管a的目的是:
①_________________________________________;
②__________________________________________;
(4)、常用同位素示踪法来确定反应物断键的情况,请用乙酸中的氧用18O,乙醇中的氧用16O写出能表示制取乙酸乙酯断键情况的化学方程式:__________________。
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示: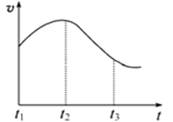
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原是,t2~t3速率变化的主要原因是。
(2)实验②放出氢气的量减少的原因是(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式:_________________________
阅读下列文字,填写文中带圈的数字后面的空白:
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:①;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③,实验2中④,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。