下图甲是氢气和氧化铜反应的实验,下图乙是木炭和氧化铁反应的实验。
(1)、在上述两个实验中,氢气和木炭表现出相同的化学性质是 性。
(2)、实验步骤的先后次序非常重要,比如甲实验中,反应前必须先通氢气后点燃酒精灯,否则易发生爆炸;反应结束后必须先 后 ,否则生成的红色的铜会变成黑色。
(3)、某同学正确操作做完乙实验后,发现澄清石灰水变浑浊,试管中粉末全部变为黑色,取少量黑色粉末,加入足量稀硫酸充分振荡,但她惊讶地发现黑色粉末没有溶解,试管中 也未产生预期的气泡,这说明该反应并没有生成
(4)、该同学查阅资料,得到关于铁的氧化物如下信息: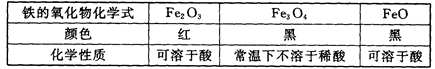
根据以上信息,试写出乙实验试管中反应的化学方程式
经分析后,该同学试着提高反应温度后,实验出现了预期的现象。
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.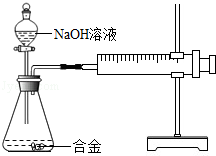
【提出问题】难道
溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:
溶于水,溶液现无色)
【进行猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有.
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的
溶液.
表1实验记录
| 实验步骤 |
实验现象 |
结论 |
| ①取一定量的合金粉末,加过量的,充分反应后过滤,滤渣备用 |
粉末部分溶解,并有无色气体放出 |
合金中一定含有 |
| ②取步骤①所得滤渣,加过量,充分反应 |
滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 |
合金中一定含有 |
【得出结论】猜想3成立.
【反思】
1.一般来说,活泼金属能与稀硫酸等算反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的基本类型是反应.
2.上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把,并不断搅拌.
3.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是.
【拓展与分析】请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱.
牙膏中常用碳酸钙、二氧化硅等物质作为摩擦剂.某同学对牙膏中摩擦剂碳酸钙的含量进行探究.
【实验原理】测定
装置中生成的
沉淀的质量,通过计算确定牙膏中
的质量分数.
【查阅资料】
,牙膏中其他成分遇到盐酸时无气体产生.
【实验装置】
根据探究过程回答下列问题:
(1)装置
中发生反应的化学方程式;
(2)实验过程中需持续缓缓通入空气,其作用有:①搅拌 、 中的反应物,使其充分反应;②.
(3)从 中过滤出 沉淀所需的玻璃仪器有烧杯、和玻璃棒;
(4)实验中准确称取三份牙膏样品,每份 ,进行三次测定,测得生成 的平均质量为 .则样品中 的质量分数为.
(5)若没有 装置,直接通入空气,则测得 的质量分数(填"偏大"、"偏小"或"不变").
碳酸氢钠(
)俗称"小苏打",在生活中用途广泛.某化学实验小组的同学对碳酸氢钠的性质进行探究.
【探究实验1】碳酸氢钠溶液的酸碱性
用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色.结论:.
【探究实验2】能与酸反应
取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:.
【探究实验3】能与碱反应
查阅资料:
;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择
溶液做试剂,通过证明有
生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验.回答下列问题: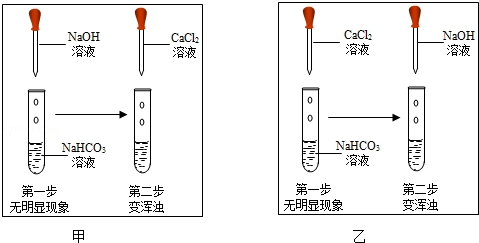
比较甲、乙两个实验的目的性区别是;
有同学提出两个实验都不足以证明有
生成,其理由;要证明有
生成,还需要进行的操作是.
一男孩在排污井盖上燃放鞭炮,点燃了排污井内的气体,井盖被炸飞,男孩被井盖击伤.
【提出问题】排污井内气体的主要成分是什么?
【查阅资料】排污井内的有机物在一定的条件下发酵产生了气体,其成分可能含有
、
、
等.
【提出猜想】某兴趣小组同学对排污井内气体含有上述气体中最少2种成分的猜想如下:
猜想Ⅰ:有
、
猜想Ⅱ:有
、
猜想Ⅲ:有
、
猜想Ⅳ:有
、
、
【实验方案】小组同学共同设计了下图所示的装置并经行探究.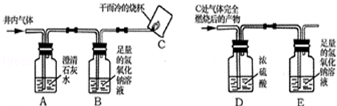
【问题讨论】
(1)装置A出现浑浊,证明猜想不正确.
(2)小明通过装置C处的现象,证明猜想Ⅲ不成立.小芳对此提出了疑义,小芳认为要在位置,再增加一个上图中(填序号)装置,才能证明猜想Ⅲ不成立.
(3)为了进一步确认气体中是否含有一氧化碳,小明将装置C处气体完全燃烧后的产物依次通过装置D、E,经实验测定装置D增重1.8g,装置E增重2.2g,由此证明猜想成立.
(4)小明认为要证明排污井内气体是否含有
,可以不用装置B,小芳则认为需要使用装置B,你认为装置B的作用是.
过氧化钠(
)为淡黄色固体,可作为潜水艇或呼吸面具的供氧剂,人呼出气体主要成分有氨气、二氧化碳、水蒸气和氧气,
能分别与
、
反应,化学方程式为:
↑;
↑.某化学兴趣小组的同学开展了以下探究活动.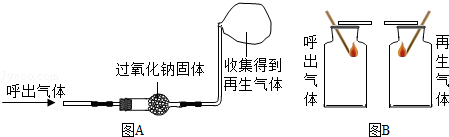
【实验探究一】将呼出气体通过下图
中的装置,收集得到一瓶再生气体.在收集一瓶呼出的气体.将两支燃着的同种木条分别同时伸入呼出气体和再生气体中,如下图
,比较分析呼出气体和再生气体中氧气含量的多少.
【分析讨论】图
的实验是通过比较来比较两种气体中氧气含量的多少.请说明呼吸面具或潜水艇用过氧化钠作为供氧剂的最大优点是.
实验探究一结束后,同学们将图
装置中的残留固体溶于水,得到了一杯无色溶液,他们对溶液的溶质成分进行探究:
【提出猜想】猜想Ⅰ:溶液是
;猜想Ⅱ:溶质是;猜想Ⅲ:溶质是
和
【实验探究二】取上述溶液少许于试管中,滴加澄清石灰水,产生的现象,证明猜想Ⅰ不成立.
同学们经过实验探究证明猜想Ⅲ成立,请你写出证明猜想Ⅲ成立的实验步骤和现象.
| 实验步骤和现象 |
结论 |
| 猜想Ⅲ成立 |