在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
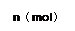  |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)求b、e的值:b= ,e=
(2)20s—40s内用N2O4表示的平均反应速率为 _;80℃该反应的化学平衡常数K为 __。
(3)改变条件达到新平衡,要使NO2在平衡体系中体积分数变小,采取的措施有 。A.向混合气体中再通入N2O4 B.保持容积不变,通入He C.使用高效催化剂 D.降低温度
(4) 如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应。则达到平衡时n(NO2) 0.60mol(填“ 大于 ” “等于” 或“ 小于”)
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在
该图中补画出该反应在60℃时N2O4物质的量的变化曲线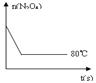
(13分)钠、铝、铁、铜等金属及其化合物在社会生活的各个领域均有重要的应用。回答下列问题:
(1)常温下将一定量的氯气通入石灰乳中,可制得漂白粉,其有效成分的化学式为___________;电解熔融态NaCl可以制得金属钠,反应的化学方程式为_____________________。
(2)Au、Cu、Fe三种块状金属中,常温下能够全部溶于足量浓硝酸的是___________; Mg(OH)2、Al(OH)3、AgOH三种氢氧化物中,能溶于氨水的是______;硬铝是由Al、Cu、Mg、Si组成的铝合金,将硬铝废料投入氢氧化钠溶液中充分反应,溶液中含有的含氧酸根离子有___________。其中铝发生反应的离子方程式为______________。
(3)FeCl3溶液可以吸收烟气中的SO2,所得溶液能与软锰矿(主要成分为MnO2)反应生成硫酸锰(MnSO4),该反应的离子方程式为_______________。
(4)等浓度的Na2CO3、H2SO4、Ba(OH)2三种溶液,若以不同顺序将体积相等的三种溶液中的两种混合,若有沉淀先过滤,再将混合液与第三种溶液混合,最终所得的溶液不可能呈________(填“酸性”、“碱性”或“中性”)。
(14分)X、Y、Z、M、N均为短周期主族元素,原子序数依次增大。Y原子最外层电子数与核外电子总数之比为3:4,M与Y同主族,N﹣、Z+、X+离子的半径逐渐减小,X、N可形成化合物A,常温下A为气体。据此回答:
(1)M在周期表中的位置是__________,Z单质与A的水溶液反应的离子方程式表示为___________。
(2)X、Z、M三种元素可形成酸式盐B,则B的电子式为_______,B中含有的化学键类型是________。
(3)X与Y、M可分别形成含有18个电子的分子C和D,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式_______________
(4)已知通常状况下1 g X2在Y2中完全燃烧放出a kJ的热量。请写出表示X2燃烧热的热化学方程式____
(5)由X、Y、Z、M四种元素组成化合物E在熔融状态下能电离出两种离子,写出E在水溶液中的电离方程式_______________。
[化学——选修5:有机化学基础]可降解塑料PCL的结构可表示为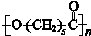 。其合成路线如下。
。其合成路线如下。
已知: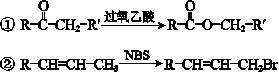
回答下列问题:
(1)B中所含官能团的名称是______。
(2)D的结构简式是______。
(3)M的分子结构中无支链。M生成D的反应类型是______。
(4)E是D的同分异构体,具有相同的官能团。E的结构简式是______。
(5)下列说法正确的是______。
a.K没有顺反异构
b.M在一定条件下可发生聚合反应
c.PCL的结构中含有酯基
(6)H与足量氢氧化钠溶液反应的化学方程式是_。
(7)M的氧化产物己二酸是合成尼龙的原料之一。用B做原料可制得己二酸,请结合相关信息完成其合成路线流程图(无机试剂任选)。______。
已知: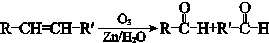
合成路线流程图示例: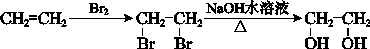
(1)无机化合物可根据其组成和性质进行分类。以下是一组对“一些物质与水反应”的分类图,请按要求填空: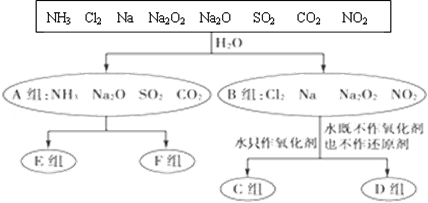
①上述分类中,分成A、B两组的依据是;
②C组物质与水反应的离子方程式为;
③D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶1的物质有(填化学式)。
(2)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
①上述反应中,H2O2既体现氧化性又体现还原性的反应是________;
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是________(填序号);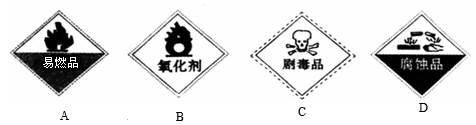
③H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN)。H2O2被称为绿色氧化剂的理由是________________。
(3)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
____CuO+____NH4Cl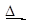 ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O
①配平此氧化还原反应方程式;
②此反应中若产生0.2mol的气体,则有________mol的电子转移。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 |
I1 |
I2 |
I3 |
I4 |
…… |
| Im/kJ·mol-1 |
578 |
1 817 |
2 745 |
11 578 |
…… |
则该元素是_______(填写元素符号)。
(2)锗(Ge)可能的性质或应用有___________。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物HOH2CCH2OH,下列叙述正确的有_______。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2-丁烯
(4)NaF晶体的熔点_________ BF4-的熔点(填>、=或<),其原因是_________。
BF4-的熔点(填>、=或<),其原因是_________。