.某校兴趣小组的同学在网上看到:茶叶是碱性食品,喝茶可以溶浴解脂肪而减肥,他们设计了探究的课题是:比较不同产地茶叶泡出液的酸碱度及茶水是否能溶解脂肪而有减肥作用。他们的实验过程如塑下:
①从市场上购买了三种不同产地的茶叶,编号为A.B.C。
②取A、B、C三种茶叶分别在相同的条件下,用开水冲泡。
③用pH试纸分别到杯中蘸取A.B.C三种茶叶的泡出液,和标准比色卡比对’测得它们的 pH分别为5.4、6. 3、6. 0。
④将形状、大小、质量相同的脂肪小块,分别放入盛有三种茶叶泡出液的相同杯中,在适宜的温度下保温5小时后,分别滤出脂肪块,吸干表面水分并称量。根据脂肪块在茶水中浸泡前后的质量变化(不考虑脂肪块吸水),判定茶水能否溶解脂肪。
请回答下列问题:
(1)以上实验操作步骤中错误的是 。
(2)在第②步实验操作中“相同的条件主要是指:水的温度、茶叶的质量、冲泡的时间及
_ _ 应相同。
(3)组内有看的同学认为,第④步实验设计不严密,需要改进的是 。在第④步实验中, 根据实验的目的,适宜的温度应控制在 左右。
(4)有人将茶水倒入有水垢的热水瓶中浸泡一下时间后振荡,发现水垢大部分消失了,产生这种现象的化学原理最可能是 。
(8分)CO2是初中化学重点研究的气体之一。某化学兴趣小组设计了如下实验来探究CO2的制取和性质:

(1)该兴趣小组用干燥管、烧杯、铜网等设计装配了一个在实验室中制取二氧化碳气体的装置,如右图所示。在干燥管内的铜网上应盛放 ;若将铜网换成铁网,可能产生的后果是 ,其原因是(用化学方程式表示) 。
(2)该兴趣小组同学将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,他们观察到前者变浑浊,后者无明显现象。CO2和NaOH是否发生了化学反应?
①小明设计了甲、乙两个实验来验证C02与NaOH发生了化学反应,如右图所示。实验现象为:甲——软塑料瓶变瘪,乙——“瓶吞鸡蛋”。
小虎同学认为上述实验是可行的。其共同原理是 。
小雯同学提出质疑,她认为上述实验还不足以说明CO2和NaOH发生了反应。其理由是
。
小明同学针对小雯的质疑又补充了一个对照实验,这个实验是
。
②小虎向甲实验后变瘪塑料瓶的溶液中加入 ,观察到
现象,从而证明CO2与NaOH已经发生了反应。
(7分)化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:

图1
A B C D E
图2
(1)写出图中带标号仪器的名称:① ② 。
(2)若实验室对你开放,请从图1中选择合适的装置,制取一种你熟悉的气体。你想制取的气体是 ,选择的发生装置是 (填序号,下同),选择的收集装置是 ,选择此收集装置的理由是 。
(3)装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
(8分)在日常生活中,我们发现切过咸菜的刀更容易生锈.而除锈用稀盐酸比稀硫酸快。为了进一步验证上述现象,某校师生做了以下相关分组实验,请你根据自己平时课堂学习的体验一起参与讨论并回答相关问题。
【步骤一】未打磨的铝片浸入氯化铜溶液中,迅速产生大量气泡和疏松的紫红色固体,并放热,片刻后溶液由蓝绿色变成无色。
(1)若要正视紫红色固体中是否含有氧化铜,可用▲溶液(填一试剂)加以检验。
【步骤二】未打磨的铝片浸入硫酸铜溶液中,一段时间内没有明显现象。
(2)比较步骤一、二,你能得出的结论是:▲。
【步骤三】打磨过的铝片浸入硫酸铜溶液中,其操作、现象和结论见下表。
(3)试将“影响因素”选项前恰当的字母序号填入答题卡指定位置。
| 实验操作 |
使用现象 |
对比结论 |
| Ⅰ.一片用粗砂纸单向用力打磨3次,将其浸入硫酸铜溶液,片刻后用镊子取出。 |
现象一:粗砂纸打磨的在划痕处有少量气泡,附着少量疏松的紫红色固体。 |
现象一与现象二对比,说明 ①▲ |
| 现象二:粗砂纸打磨的片刻内现象不明显。 |
||
| Ⅱ.一片用特细砂纸往复打磨数次,再将其浸入硫酸铜溶液,片刻后取出。 |
现象三:特细砂纸打磨的表面产生较多细小气泡,表面均匀附着紫红色固体。 |
现象三与现象一对比,说明 ②▲ |
| 现象四:特细砂纸打磨的表面一段时间内没有明显现象。 |
现象四与现象三对比,说明 ③▲ |
★影响因素:
A.打磨时用力程度及均匀程度不同
B.选用砂纸颗粒粗细程度不同
C.由于摩擦生热又形成了新的氧化膜
(4)比较步骤三各实验操作中用砂纸打磨的作用是:▲。
(5)请仔细观察下图: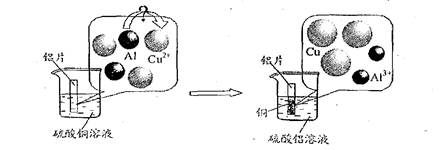
试从微观粒子变化的角度分析该反应的实质是:
▲。
(6分)酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的H+和碱溶液中大量自由移动的OH-结合成水分子的过程。请根据以下氢氧化钠溶液与稀盐酸反应的实验,回答问题。
【实验1】用酚酞试液
(1)向一锥形瓶中倾倒20g质量分数为4.00%的氢氧化钠溶液,滴入3滴酚酞试液,振荡,再逐滴滴入质量分数为3.65%的稀盐酸,边滴边振荡,直至溶液刚好变为色为止,共用去稀盐酸20g,则反应后溶液中溶质质量分数为(结果精确到0.1%)。反应后溶液中的溶质可用的方法(填一操作名称)使其析出。用酚酞作指示剂可逐滴控制酸、碱溶液反应的量,视觉效果灵敏,操作简便。
【实验2】用pH试纸
(2)向一支试管内倒入约2mL氢氧化钠溶液,再逐滴滴入盐酸,边滴边振荡。然后用玻璃棒蘸取反应液沾到pH试纸上,与标准比色卡对照。因无法通过肉眼观察到反应进程,需间隔数滴多次检测溶液的pH,所以每使用玻璃棒蘸取溶液前,必须进行的预处理。
【小结】
(3)除了用酸碱指示剂、pH试纸外,还可用(填力法)检测中和反应是否发生。
维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同。下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量。
【实验目的】测定不同饮料中维生素C的含量。
【实验原理】
(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
(2)淀粉遇到碘水变色。
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
【实验过程】
步骤1:在4支试管中分别盛有3.0 mL的下列物质:①蒸馏水,②标准维生素C溶液,
③橙汁,④果味饮料。分别向4支试管中滴加2滴淀粉溶液。
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数。
【实验记录】
| 测定物质 |
① |
② |
③ |
④ |
| 滴入碘水的数量(滴) |
1 |
8 |
15 |
5 |
试回答下列问题:
(1)你认为小明测定的两种饮料中, 的维生素C的含量较高;
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:
;
(3)化学实验需要控制变量。下列 (填序号)情况会影响到测定结果。
A.每次实验所用饮料的颜色不同 B.量取的被测试物质的体积不同
C.试管的大小不同 D.没有用同一规格的胶头滴管滴加碘水
【回顾与反思】实验中所用的淀粉溶液的作用是。