氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1 KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e— C12↑阴极:2H2O+2e— H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂
是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O7,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O3与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O7标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O3—的质量分数,步骤4的操作内容是 。
某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下: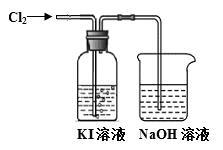
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是 。
(2)KI溶液变为黄色说明氯气具有的 性,该反应的离子方程式 。
(3)已知I2+I- I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行以下实验。
I3-,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行以下实验。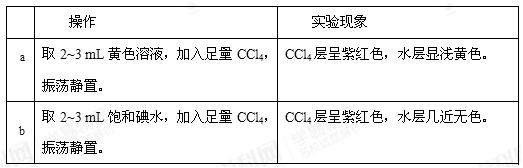
①实验b的目的是 。
②根据实验a中,水层中含有的粒子有 。
③用化学平衡原理解释实验a中水溶液颜色变浅的原因: 。
④为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为 。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是 。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为 。
(6)溶液最终变为浅绿色的原因是 。
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:
20℃时溶解度/g
| CaCO3 |
CaSO4 |
Mg(OH)2 |
MgCO3 |
| 1.4×10-3 |
2.55×10-2 |
9×10-4 |
1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式: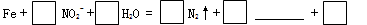
②下面检测钝化效果的方法合理的是 。
a. 在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b. 在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c. 在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d. 在炉面上滴加浓HNO3,观察出现红棕色气体的时间
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+ SO32- (aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:
①溶液E和F分别为 、 。
②请用化学平衡原理解释步骤3中溶液由红棕色变为浅绿色的原因 。
(14分,每空2分)某中学的化学兴趣小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 。漂白粉在空气中变质的原因 (用化学反应方程式说明)。
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
氮化硅的强度很高,尤其是热压氮化硅,是世界上最坚硬的物质之一,氮化硅陶瓷可做燃气轮机的燃烧室、机械密封环、输送铝液的电磁泵的管道及阀门、永久性模具、钢水分离环等。制备氮化硅可将硅粉放在氮气中加热至1000℃左右直接氮化制得,实验室制备氮化硅装置示意图如下: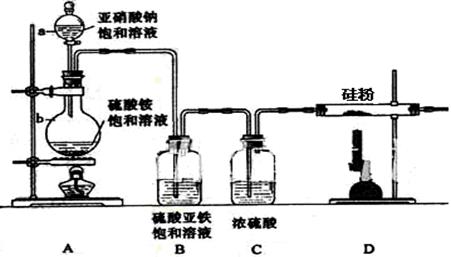
回答下列问题:
(1)检查装置气密性的方法是 ,a仪器的名称是 。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)装置B的作用是 ,装置C的作用是 ;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式: ;
(5)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是()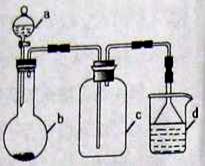
| 选项 |
a物质 |
b物质 |
c收集的气体 |
d中的物质 |
| A |
浓氨水 |
NaOH |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
澄清石灰水 |
| C |
稀硝酸 |
Fe |
NO2 |
H2O |
| D |
浓盐酸 |
KMnO4 |
Cl2 |
NaOH溶液 |