中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是 。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进
行反应与上述实验相比,所放出的热量 (填“相等”“不相等”),若实验操作均正确,则所求中和热 填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
.实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 |
B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 |
E.生成白色胶状沉淀,继而沉淀消失 |
请你帮助该同学整理并完成实验报告:
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlC13溶液、NaOH溶液、酚酞溶液等。
实验所用到的玻璃仪器:①、②、③以及胶头滴管、玻璃片等。
(2)实验内容:(填写与实验步骤对应的实验现象的编号和②的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
| 实验现象(填A~F) |
B |
(3)此实验的结论:钠、镁、铝的金属性强弱。
某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。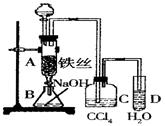
(1)写出A中反应的化学方程式______________________________;
(2)观察到D中的现象是______________________________;
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____________,写出有关的化学方程式______________________________;
(4)C中盛放CCl4的作用是______________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是__________________。
氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。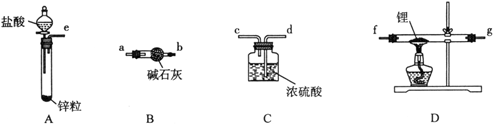
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________,加入药品前首先要进行的实验操作是__________(不必写出具体的操作方法);其中装置B的作用是______________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是________________________________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作________。
(4)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:LiH + H2O =" LiOH" + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式______________________________________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
(6)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放,所以在最后连接了装置E用来收集H2,请将E装置补充完整。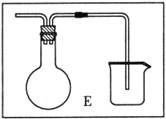
二氧化氯( ClO2)是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用“隋性”气体进行稀释,并尽可能防止震动和避光。因此,二氧化氯的制备方法一直是科学家长期寻求解决的问题,目前比较理想的方法是用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。已知,ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为一59℃,沸点为11.0℃,易溶于水。某学生拟用图1所示装置模拟工业制取并收集ClO2.
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、。
(2)B装置必须放在冰水浴中,其原因是。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2.3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②;③;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的Ⅺ晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol∙L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32- =2I- +S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30min”,立即进行步骤3,则测定的结果可能(选填“偏大”、“偏小”或“无影响”)。
②上述步骤3中滴定终点的现象是。
③根据上述步骤可计算出原ClO2溶液的浓度为g-L一1,(用含字母的代数式表示)。
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一)探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
A、乙醇 B、C、NaOH溶液。
(1)B中盛装的试剂(填化学式)
(2)A中加入乙醇的目的是。
(二)探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是(用离子方程式表示)。
(三)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:MnO4-+H2C2O4+=Mn2++CO2↑+H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于(填“酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验组别 |
c(H2C2O4) /(mol/L) |
V(H2C2O4) /ml |
c(KMnO4) /(mol/L) |
V(KMnO4) /ml |
c(H2SO4) /(mol/L) |
褪色所需时间 |
实验 目的 |
| 1 |
0.2 |
2 |
0.0025 |
4 |
0.12 |
6'55'' |
(a) |
| 0.2 |
2 |
0.005 |
4 |
0.12 |
5'17'' |
||
| 0.2 |
2 |
0.01 |
4 |
0.12 |
3'20'' |
||
| 0.2 |
2 |
0.02 |
4 |
0.12 |
9'05'' |
||
| 0.2 |
2 |
0.03 |
4 |
0.12 |
11'33'' |
||
| 0.2 |
2 |
0.04 |
4 |
0.12 |
14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是。