甲苯二异氰酸酯(简称TDI)是一种重要的化工原料,是制造聚氨酯系列产品的原料之一。而工业TDI产品是2,4-甲苯二异氰酸酯与2,6-甲苯二异氰酸酯的混合物。工业上生产TDT的方法有几种,但比较成熟和经济的方法是胺光气化法。下图为工业上用“胺光气化法”合成TDI后生产某聚氨酯产品的主要反应流程图(副产物没有标出)
已知:第③、④和⑤步反应两物质等物质的量反应。试回答:
⑴写出光气(COCl2)和流程图中A的结构简式:
、 ;
⑵按要求写出与第①步反应产物(见流程图)互为同分异构体的结构简式或数目。
A、只呈碱性的芳香族化合物(任写一种) ;
B、既呈碱性又呈酸性的芳香族化合物的种数为 。
⑶已知聚氨酯X链节中含有 结构。第⑤步反应类型为 ,
结构。第⑤步反应类型为 ,
聚氨酯X的结构简式: 。
⑷写出反应④的化学方程式: 。
⑸资料显示,TDI在大于45℃时会发生两分子聚合成二聚物,此二聚物中除了苯环外还含有两个四元环(由C、N原子构成),写出上述流程图中TDI的一种结构自身反应生成的二聚物 的结构简式。
的结构简式。
。
为防止碘缺乏病,通常在食盐中添加少量碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应。请配平化学方程式,用双线桥标出电子转移的方向与数目。
□KI+□KIO3+□H2SO4——□I2+□K2SO4+□H2O
此反应中,氧化剂是,还原剂是。
现有金属单质A、B 、H、I和气体甲、乙、丙及物质C、D、E、F、G。其中B是地壳中含量第二的金属。他们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。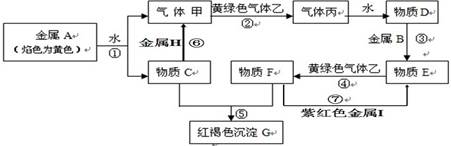
请根据以上信息回答下列问题:
⑴写出下列物质的化学式:B;乙。
⑵写出反应①的离子方程式:。
写出反应⑥的化学方程式:。
写出反应⑦的离子方程式:。
⑶实验室检验物质F中阳离子的常用试剂为。
选用下列物质填空(填序号)
①二氧化碳②二氧化硫③氮氧化物④氟氯昂
⑴会破坏臭氧层的物质是。
⑵过量会导致温室效应加剧的物质是。
⑶造成酸雨的物质是。
⑷导致光化学烟雾的物质是。
乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1) 当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=;
(2) 当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b=,得到的CO和CO2的物质的量之比n(CO):n(CO2)=。
(3) a的取值范围是;b的取值范围是。
(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化: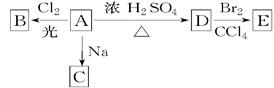
①A分子中的官能团名称是;
②A只有一种一氯取代物B。写出由A转化为B的化学方程式
;
③A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)。
①加成反应②氧化反应③加聚反应④水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。
“TBHQ”的结构简式是。