对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体,某兴趣小组利用中学的简单有机物进行合成,其方案如下:
(1)A的结构简式是 ,E中含有的官能团名称是 。
(2)指出化学反应类型:① ;② 。
(3)丁子香酚(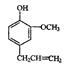 )是一种重要的调味剂,它与F的关系是 。
)是一种重要的调味剂,它与F的关系是 。
a.同系物 b.同分异构体 c.同种物质
(4)下列物质不能与丁子香酚发生反应的是 。
a.NaOH溶液 b.NaHCO3溶液 c.Br2的四氯化碳溶液 d.乙醇
(5)写出反应③的化学方程式: 。
比较原子半径的大小(填“>”或“<”,下同):OF;K+Ca2+。
比较酸性强弱: H3PO4H2SiO3
稳定性:NH3 ________ PH3
H2O2、KCl、Na2SO4、Na2O2、HCl、O2中只含离子键的是,只含极性键的是,只含非极性键的是,既含离子键又含极性键的是,既含离子键又含非极性键的是,既有极性键又有非极性键的是。
某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: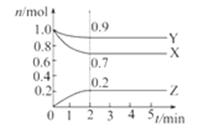
该反应第 ______ 分钟到达平衡状态 。
该反应的化学方程式为。
反应开始至2 min,气体X的平均反应速率为。
由以下一些微粒:136C、3919K、4020Ca、126C、147N、4018Ar。其中:互为同位素的是________和________;
质量数相等,但不能互称同位素的是_________和__________;
中子数相等,但质子数不相等的是______和____ _、______和。
下表是元素周期表的一部分,回答下列有关问题:
| 周期\主族 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑪ |
⑫ |
写出下列元素符号:④;⑫。
画出原子的结构示意图:⑤;⑪。
在①~⑫元素中,金属性最强的元素是_________,非金属性最强的元素是_______,最不活泼的元素是________。(均填元素符号)
元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应 第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成 (填离子或共价)化合物。
元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为____________该氧化物中含有的化学键是_________键(填“离子”或“共价”)
在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4 mol,则用元素①的单质表示的反应速率为________________________。
通常用活性炭去除冰箱中的异味,主要利用了活性炭的
| A.吸附性 | B.还原性 | C.稳定性 | D.氧化性 |