已知
化学反应①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1;
化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数K2。
在温度973 K和1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通常表格中的数值可以推断:反应①是____________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=____________。
(3)根据反应①与②可推导出 K1、K2与K3之间的关系式____________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有____________(填写序号)。
K1、K2与K3之间的关系式____________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有____________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度 D.升高温度
E .使用合适的催化剂 F.设法减少CO的浓度
.使用合适的催化剂 F.设法减少CO的浓度
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
(1)该反应的平衡常数表达式K=。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。8分钟内,CO的平均反应速率v(CO)=mol/(L·min)。
(3)下列措施中能使平衡时c(CO)/c(CO2)增大的是(填序号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加入一些铁粉 |
(4)铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应式是。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为。
钡盐行业生产中排出大量的钡泥,主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下(已知溶液中Fe3+沉淀完全的pH=3.7):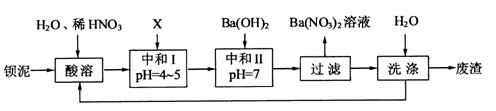
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是。
(3)该厂结合本厂实际,选用的X为(填化学式);中和Ⅰ使溶液中(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质,且受热易升华。实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃。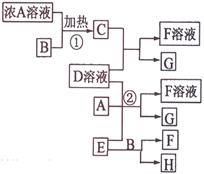
请回答下列问题:
(1)反应①的化学方程式为。
(2)反应②的离子方程式为。
(3)写出另外一种实验室制取H的化学方程式。
(4)已知D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。若D的浓度为1.0×10—2 mo1/L ,将等体积的D溶液与Pb(NO3)2溶液混合,则生成沉淀所需 Pb(NO3)2溶液的最小浓度为mol/L。
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是。
(3)KMnO4的氧化性比Cl2的氧化性(选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、。
②应用托盘天平称取KMnO4固体g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |
(15分)有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
请回答下列问题: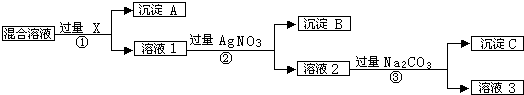
(1)写出实验流程中下列物质化学式:试剂X,沉淀A,沉淀B。
(2)①、②、③过程中均需要过滤,在进行此操作时需要用到的玻璃仪器为:、、。
(3)上述实验流程中加入过量的Na2CO3的目的是。
(4)按此实验方案得到的溶液3中肯定含有Na2CO3杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。