I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是 。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为 。
SO2按还原性由强到弱顺序排列为 。
II .(4) 除去铁粉中混有铝粉的试剂是 ,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
【化学---选修2:化学与技术(15分)】MgSO4·7H2O在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100 g水)
| 温度/ ℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: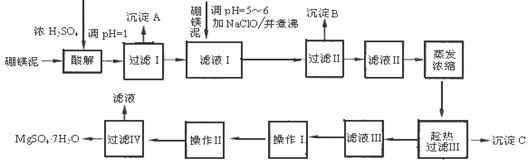
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)沉淀C的化学式是
(2)过滤Ⅲ需趁热过滤的理由是
(3)操作Ⅰ和操作Ⅱ的名称分别为、
(4)滤液I中加入硼镁泥,调节溶液的pH=5~6,可除去滤液Ⅰ中(填离子符号);加入NaClO溶液加热煮沸,可将Fe2+氧化成Fe3+的同时,还会将溶液中的Mn2+氧化成MnO2,写出Mn2+被氧化成MnO2的离子反应方程式为
(5)硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣。将硼镁矿(Mg2B2O5·H2O)煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应,试写出反应方程式
(15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源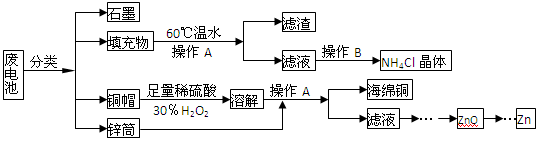
(1)填充物用60 ℃温水溶解,目的是。
(2)操作A的名称为。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:。
(14分)
(1)已知:①N2(g)+O2(g)=2NO(g)△H=+179.5 kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3 kJ/mol
③2NO(g)+2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
NO2(g)+CO(g)=NO(g) +CO2(g) △H=kJ/mol。
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min[ |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为,此温度下的平衡常数为,温度升高时平衡常数会(填“增大”、“减小”或“不变”)。
②650 ℃时,若在此容器中开始充入2 mol H2O(g)、1 mol CO、1 mol CO2和 2 mol H2,若要使反应在开始时进行。(填“正向”、“逆向”)
③若a=2,b=1,则c=,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O)α3 (CO)(填“<”、“>”或“=”)。
[化学——选修3:物质结构与性质](15分)硼(B)及其化合物在化学中有重要的地位。请回答下列问题:
(1)Ga与B同主族,Ga的基态原子核外电子排布式为,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序是。
(2)硼酸(H3B03)是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
①硼酸中B原子的杂化轨道类型为。
②硼酸晶体中存在的作用力有范德华力和。
③加热时,硼酸的溶解度增大,主要原因是。
④硼酸是一元弱酸,在水中电离时,硼酸结合水电离出的OHˉ而呈酸性。写出硼酸的电离方程式_。
(3)硼氢化钠(NaBH4)是有机化学中的一种常用还原剂,在热水中水解生成硼酸钠和氢气,用化学方程式表示其反应原理。[BH4]-的空问构型是____。
(4)B3N3H6可用来制造具有耐油、耐高温性能的特殊材料。写出它的一种等电子体物质的分子式。
(5)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,下图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为 。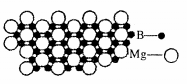
(6)金刚石的晶胞如图。立方氮化硼的结构与金刚石相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是____g·cmˉ3(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。
[化学——选修2:化学与技术](15分)利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
(1)操作a的名称,实验室中进行此操作时用到的玻璃仪器有 。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为。
(4)水泥常用做建筑材料,是利用了水泥的性质。
(5)SO2的催化氧化反应为2SO2(g)十02(g)  2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
①实际生产中,S02的催化氧化反应是在常压、400 ℃ —500 ℃ 条件下进行。采用常压的主要原因是;该反应化学平衡常数大小关系是:K(400 ℃ ) K(500 ℃)(填“>”、“<”或“="”" )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2C03溶液、酚酞试液
c、碘水、淀粉溶液d、KMn04溶液、稀硫酸