甲醇是一种非常好的燃料。熔点-97.8°C,沸点64.5°C。一定条件下,
CO与H2反应可制得甲醇:CO+2H2  CH3OH
CH3OH
图1表示该反应进行过程中的能量变化:
图2表示100°C,在体积为2L的恒容容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
(1)已知CO的燃烧热为283kJ/mol,H2的燃烧热为285.8kJ/mol,结合图1写出液态CH3OH燃烧热的热化学方程式 。
(2)根据上图2计算:该温度下,反应CO(g)+2H(g) CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
CH3OH(g)的平衡常数为 ;10min后,容器内的压强变为原来的 倍;改变下列条件,能提高CO转化率的是 。
A.降低温度 B.加催化剂
C.充入氩气,使体系压强增大 D.再充入1molCO和2molH2
E.恒温恒容改为恒温恒压
(3)已知:CH3OH可以在一定条件下转化为HCOOH,HCOOH和CH3COOH性质相似。25°C,0.1mol/LHCOOH溶液的pH>1。室温下,向0.1mol/L的HCOOH溶液中滴加NaOH溶液,当溶液中离子浓度关系满足:c(HCOO-)<c(Na+)时,则反应的情况可能为 。(填字母)
A.NaOH不足,HCOOH剩余
B.HCOOH与NaOH恰好完全反应
C.NaOH过量
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如图所示。
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4B.HNO3C.H2O2D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH生成Fe(OH)3反应的离子方程式 。
(5)298K时残留在乙溶液中的c(Fe3+)在 mol/L以下。Fe(OH)3的KSP= 2.70×10-39
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。请回答以下问题:(1)硫酸工厂的酸性废水中砷(As)元素(主要以弱酸H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉降法处理含砷废水。
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为 ,AsH3的稳定性比NH3的稳定性 (填“强’’或“弱’’)。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成难溶的三硫化二砷,该反应的离子方程式为 。
(2)今年8月1 2日晚,天津滨海新区危险品仓库发生爆炸事故,少量氰化物因爆炸冲击发生泄漏,CN一有剧毒,泄露会污染水源和空气,需要处理。
①已知HCN力一元弱酸,则NaCN溶液的pH 7(填“>”“=”或“<”)。
②处理含CN一废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3一,同时生成NH3,该反应的离子方程式为 方法二:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如右图所示(图中“HA”表示乳酸分子,A表示乳酸根离子)。阳极的电极反应式为 简述浓缩室中得到浓乳酸的原理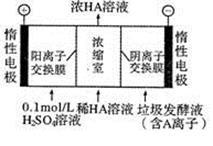
高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量0.8 mol d.还原性的强弱:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)写出KMnO4与(NH4)2Fe(SO4)2反应的离子方程式: 。
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。需要的玻璃仪器有.
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。请回答:
(4)用软锰矿制备K2MnO4的化学方程式是: 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。并用单线桥表示电子的转移情况 。
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol.L-1计算)。
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Mn2+ |
8.3 |
9.8 |
| Cu2+ |
4.4 |
6.4 |
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为_____________。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g) =2Cu2O(s)+2SO2(g)△H="-" 768.2 kJ.mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2 (g)△H="+116.0" kJ.mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为_____________。
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2。假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0 kg这样的辉铜矿最多能制备 kg无水Cu(NO3)2。
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):
(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。