已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。
(3)在相同温度和压强下,对反应A(g)+B(g)C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| |
A |
B |
C |
D |
| 甲 |
a mol |
a mol |
0 |
0 |
| 乙 |
2a mol |
a mol |
0 |
0 |
| 丙 |
a mol |
a mol |
a mol |
a mol |
| 丁 |
a mol |
0 |
a mol |
a mol |
上述四种情况达到平衡后,C(D)的大小顺序是________。
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是____
A.气体平均摩尔质量不再变化 B. 气体压强不再变化
C. 气体密度不再变化 D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1 F. C生成的速率等于B消耗的速率
下图是中学化学的一个重要定量实验过程示意图,回答下列问题:
(1)该实验中的一处错误是。
(2)该实验中,能较精确确定液体体积的两种玻璃仪器是、。
(3)操作过程中多次用到玻璃棒,请分别说明它们在实验中的作用:操作②中、操作③中。
(4)不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响(填“偏大”、“偏小”或“无影响”)。
a.在第②步操作中,有少量液体溅出烧杯外:。
b.在第③步操作中,容量瓶内本来有少量水:。
c.在第⑤步操作中,若俯视刻度线:。
d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线:。
(5)若操作全部正确,最后所得的溶液应存放在试剂瓶中,并贴上标签,请填写标签上的内容(如图)。
现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32—、SO42—。现取3份100 mL该溶液分别进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到标准状况下20.16 L气体;
第三份加入足量BaCl2溶液后,经过滤、洗涤、干燥、得到白色沉淀,再将沉淀经足量盐酸洗涤,发现沉淀部分溶解。
根据上述实验,试回答下列问题:
(1)由第一份进行的实验对Cl-是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”);
(2)由第二份进行的实验得知该混合物中应含有(填离子符号),其物质的量浓度为;
(3)第三份实验中最终得到的沉淀成分为;(填化学式)
(4)综合上述实验,你认为以下结论正确的是。
| A.该混合液中一定含NH4+、CO32—、SO42—、K+,可能含Cl— |
| B.该混合液中一定含NH4+、CO32—、SO42—,可能含K+、Cl— |
| C.该混合液中一定含NH4+、CO32—、SO42—,可能含Mg2+、K+、Cl— |
| D.该混合液中一定含NH4+、SO42—,可能含Mg2+、K+、Cl— |
(15分)资源化利用CO2不仅可以减少温室气体的排放,还可以重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式为:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ/mol,该反应中每生成1mol Fe3O4,转移电子的数目为。
(2)在一定条件下,二氧化碳转化为甲烷的反应为:CO2(g)+4H2(g)  CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol/L, H2 0.8 mol/L, CH4 0.8 mol/L, H2O 1.6 mol/L。起始充入CO2和H2的物质的量分别为、。CO2的平衡转化率为。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1mol CO2和4molH2,在Ⅱ中充入1mol CH4和2molH2O(g),300℃开始反应,达到平衡时,下列说法正确的是()(填字母)。
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅱ中反应的平衡常数相同 |
| C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1 |
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如下图所示: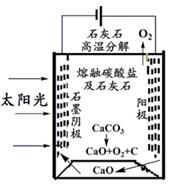
①上述生产过程的能量转化方式是、。
②上述电解反应在温度小于900℃时进行,碳酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极电极反应式为,阴极电极反应式为。
(10分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为: H2SO4=H++HSO4-,HSO4- H++SO42-。.
H++SO42-。.
请据此回答下列有关问题:
(1)Na2SO4溶液呈(填“弱酸性”、“中性”或“弱碱性”),原因是:(用离子方程式表示)。
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式:;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 |
| B.c(SO42-)+c(HSO4-)=2c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) |
| D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度0.01mol·L-1(填“>”“=”或“<”),原因是。
(6分)(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用同样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为。
(2)NO2可用氨水吸收生产硝酸铵,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是(用离子方程式表示)。向该溶液中滴加bL氨水后溶液显中性,则滴加氨水的过程中水的电离平衡将会(填“正向”、“逆向”或“不”) 移动,所滴加氨水的浓度为mol/L。(已知氨水的电离平衡常数Kb=2×10-5)