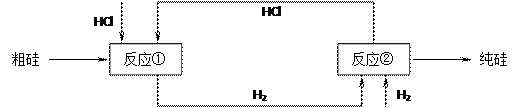科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);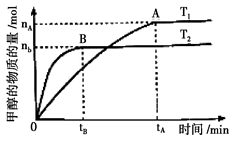
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应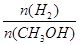 ④处于A点的反应体系从T1变到T2,
④处于A点的反应体系从T1变到T2,
达到平衡时增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
卤代烃(RX)可以合成格氏试剂(RMgX),合成格氏试剂及格氏试剂有关应用如下:(R为烃基,R1、R2为烃基或氢原子)
请回答下列问题:
⑴如上反应②的类型是。
⑵CH3CH2MgCl与CO2在酸性水溶液中反应可生成有机物X,则X的结构简式为:。
⑶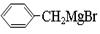 与丙酮(CH3COCH3)在酸性水溶液中反应可生成有机物Y,有机物Y的同分异构体很多,其中属于酚类且苯环上除酚羟基外只有一个取代基的同分异构体共有种。
与丙酮(CH3COCH3)在酸性水溶液中反应可生成有机物Y,有机物Y的同分异构体很多,其中属于酚类且苯环上除酚羟基外只有一个取代基的同分异构体共有种。
⑷由正丙醇合成正丁醇的合成路线如下:
请回答下列问题:
①D的化学式。
②写出与正丁醇互为同分异构体且在一定条件下能被CuO氧化,氧化产物能发生银镜反应的物质的结构简式:。 ③写出B C的化学方程式:
③写出B C的化学方程式:
氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g)  H2(g) + CO(g)△H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g)△H =" +131.3" kJ ,△S =" +133.7" J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g) N2 (g)+ 3H2(g)的K= (填数值)。
N2 (g)+ 3H2(g)的K= (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能,1>2 |

现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A~F六种元素原子,原子半径最大的是 (填序号)。
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: 。
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: 。
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为: 。
A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 。
(2)当n=2时,B原子的结构示意图为 ,B与C形成的晶体属于晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ,该晶体中最小的环共有 个微粒构成,微粒间的作用力是 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
(用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
| 编号 |
I |
II |
III |
IV |
V |
| V(O2)/mL |
60 |
40 |
20 |
12 |
10 |
| V(空气)/mL |
40 |
60 |
80 |
88 |
90 |
| 现象 |
木炭复燃 |
木炭复燃 |
木炭复燃 |
木炭有时燃烧,有时不燃烧 |
木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 |
制取气体A(下列反应产生的混合气体) |
B中的现象 |
结论 |
| a |
在烧瓶中加热适量浓HNO3 4HNO3△4NO2↑+O2↑+2H2O↑ |
充满红棕色气体,木炭不复燃,火星熄灭 |
NO2不支持燃烧 |
| b |
加热AgNO3固体 2AgNO3△2NO2↑+O2↑+2Ag |
充满红棕色气体,木炭复燃 |
NO2支持燃烧 |
| c |
加热Cu(NO3)2固体 2Cu(NO3)2△4NO2↑+O2↑+2CuO |
充满红棕色气体,木炭复燃 |
NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ,原因是 。
b. ,原因是 。
c. ,原因是 。
工业生产粗硅的主要原理为:SiO2+2C 3273K Si(粗)+2CO↑。
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 。
(2)工业上可通过如下流程由粗硅制取纯硅:
|
|||||
|
|
||||


 Si(粗)SiCl4(l) Si(纯)
Si(粗)SiCl4(l) Si(纯)