黄血盐(亚铁氰化钾,K4[Fe(CN)6] )易溶于水,广泛用做食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10 mg·kg-1。黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾。
回答下列问题:
(1)写出基态Fe2+的核外电子排布式 。K4[Fe(CN)6] 中Fe2+与CN-之间的作用力是 。
(2)CN-中碳原子的杂化方式为 ;1molCN-中含有π键的数目为 。
(3)金属钾、铁的晶体的晶胞结构如下图,钾、铁两种晶体晶胞中金属原子的配位数之比为 。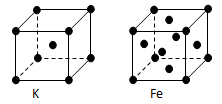
(4)黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为 。
选做(15分)【化学选修3:物质结构与性质】
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满。请回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为。(用元素符号表示)
(2)已知YZ2+与XQ2互为等电子体,则l mol YZ2+中含有π键数目为。
(3)Z的气态氢化物沸点比Q的气态氢化物高得多,其原因是。
(4)Y、Z与氢元素可形成化合物HYZ3,是实验室常用试剂。HYZ3分子中Y的杂化方式为,YZ3—的空间构型是。
(5)E原子的价层电子排布式为;E有可变价态,它的基价态的离子与Z的阴离子形成晶体的晶胞如图所示。
①该晶体的化学式为,Z的阴离子的配位数为。
②Z的阴离子的堆积模型为。
A.简单立方B.六方最密C.面心立方
③已知晶胞边长为apm,则晶胞的密度为g• cm—3(阿伏加德罗常数用NA表示)。
选做(15分)【化学选修2:化学与技术】
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
(1)“浸出”时,原料中的铜均转化为硫酸铜。写出相应的化学方程式:。
(2)试剂b是(填物质名称),其反应的离子方程式:。
(3)调节pH的目的是。滤渣c是。
(4)在农业上,将胆矾、生石灰和水按一定比例混合制成波尔多液,其反应的化学方程式为。
(5)气体a可以被循环利用,用化学方程式表示其被循环利用的原理为:。
(6)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式:。
(8分)
Ⅰ.醋酸是常见的弱酸。用0.1 mol•L—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol•L—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。
(1)滴定醋酸的曲线是(填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是。
(3)V1和V2的关系:V1V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。
(1)通过计算确定C点剩余固体的化学成分为(填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式:。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
(10分)已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g) SO2C12(g)
SO2C12(g) H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。
H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。
(1)化合物SO2Cl2中S元素的化合价是。
(2)用二氧化锰和浓盐酸制氯气的化学方程式为。
(3)用如图所示的装置制备SO2Cl2,下列说法正确是(选填编号)
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性碳作催化剂
c.装置C处吸滤瓶应放在冰水中冷却,更有利于SO2Cl的收集
(4)B处反应管冷却水应从(填“m”或“n”)接口通入,
从化学平衡移动角度分析,反应管通水冷却的目的是,D处U形管中盛放的试剂可以是。
(5)向C中所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子只有SO42—、Cl—(OH—除外),写出SO2Cl2与H2O反应的化学方程式。
(6)已知室温下,Ksp[AgCl]=2.0×10—10,Ksp[Ag2SO4]=1.6×10—5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,使SO42—和Cl—完全沉淀。当浊液中Ag+浓度为0.1 mol/L时,此浊液中Cl—与SO42—的物质的量浓度之比为。
(10分)甲醇合成反应为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)合成甲醇的反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式。
(2)实验室在lL密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L—l)
| 温度\时间 |
10min |
20min |
30min |
40min |
50min |
60min |
| 300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
①300 ℃时反应开始10分钟内,H2的平均反应速率为;
②500 ℃时平衡常数K的数值为;
③300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(选填编号)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时 减小
减小
(3)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①甲中负极的电极反应式为;
②乙中A极析出的气体在标准状况下的体积为;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要mL5.0 mol•L—lNaOH 溶液。