下图分别为NaCl、CsCl及金刚石的晶体结构模型。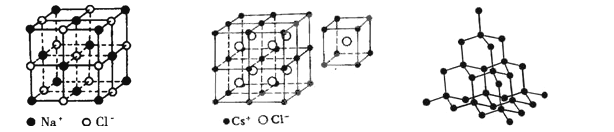 ⑴ 在NaCl晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。在一个NaCl晶胞中,Cl-离子的个数等于________,Na+离子的个数等于________。
⑴ 在NaCl晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。在一个NaCl晶胞中,Cl-离子的个数等于________,Na+离子的个数等于________。
⑵ 在CsCl晶体中,每个Cs+离子周围与它最接近的且距离相等的Cs+离子共有_____个。每个Cs+离子周围与它最接近的且距离相等的Cl-离子共有_____个。
⑶ 在金刚石晶体中,每个C原子周围有________个C—C键,1 mol金刚石,含 C—C键________mol。
⑷ 如果将金刚石晶体结构模型中的C原子换成Si原子,并在每个Si—Si键中间插入O原子就成了SiO2的晶体结构模型。那么在SiO2晶体中,每个Si原子周围有______个O原子,每个O原子_______个Si原子;每个Si原子周围有_______个Si—O键,1mol SiO2中含有_____mol Si—O键。
在有机反应中,反应物相同而条件不同会得到不同的主产物.下式中R代表烃基,副产物均已略去.
(请注意H和Br所加成的位置)
写出实现下列转变的各步反应的化学方程式,注意写明反应条件.
(1)由CH3CH2CH2CH2Br分两步转变为
CH3CH2CHBrCH3;
(2)由(CH3)2CHCH===CH2分两步转变为
(CH3)2CHCH2CH2OH.
C3H7Cl的结构有两种,分别为CH3CH2CH2Cl和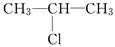
(1)CH3CH2CH2Cl在NaOH水溶液中受热反应的化学方程式是________________________________________________________________________,
反应类型为________.
(2) 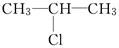 在NaOH乙醇溶液中受热反应的化学方程式是
在NaOH乙醇溶液中受热反应的化学方程式是
________________________________________________________________________,
反应类型为________.
比赛中,当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理.乙烯和氯化氢在一定条件下制得氯乙烷的化学方程式(有机物用结构简式表示)是____________________________.该反应的类型是________反应.决定氯乙烷能用于冷冻麻醉应急处理的具体性质是___________________.
人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题:
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个三键且无支链的链烃的结构简式________.
(2)已知分子式为C6H6的有机物有多种,其中的两种为:(Ⅰ)  、
、 .
.
①这两种结构的区别表现在以下两方面:
定性方面(即化学性质方面):(Ⅱ)能________(填字母),而(Ⅰ)不能.
a.被高锰酸钾酸性溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时:(Ⅰ)需要H2________mol,而(Ⅱ)需要H2________mol.
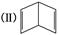
②今发现C6H6还可能有一种如图所示的立体结构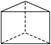 ,该结构的二氯代物有________种.
,该结构的二氯代物有________种.
(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断它的结构简式可能是________(填字母).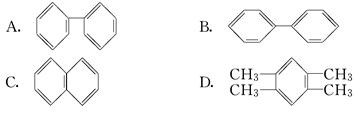
(4)现代化学认为,萘分子中碳碳键是________.
某一定量的苯的同系物完全燃烧,生成的气体依次通过浓硫酸和碱石灰,经测定,前者质量增加10.8 g,后者质量增加39.6 g(设均为完全吸收).又知经氯化处理后,该苯的同系物苯环上的一氯代物、二氯代物、三氯代物都只有一种,根据上述条件:
(1)推断该苯的同系物的分子式为____________;
(2)写出该苯的同系物的结构简式为____________.