人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题:
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个三键且无支链的链烃的结构简式________.
(2)已知分子式为C6H6的有机物有多种,其中的两种为:(Ⅰ)  、
、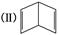 .
.
①这两种结构的区别表现在以下两方面:
定性方面(即化学性质方面):(Ⅱ)能________(填字母),而(Ⅰ)不能.
a.被高锰酸钾酸性溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时:(Ⅰ)需要H2________mol,而(Ⅱ)需要H2________mol.
②今发现C6H6还可能有一种如图所示的立体结构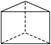 ,该结构的二氯代物有________种.
,该结构的二氯代物有________种.
(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断它的结构简式可能是________(填字母).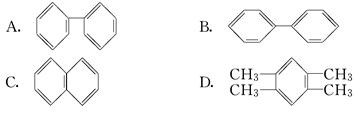
(4)现代化学认为,萘分子中碳碳键是________.
氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径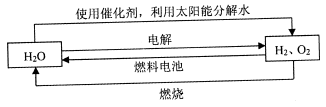
(1)上图中4个过程中能量转化形式有_____________
| A.2种 | B.3种 | C.4种 | D.4种以上 |
(2)电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
2H2O(1) 2H2(g)+O2(g)△H1
2H2(g)+O2(g)△H1
2H2O(1) 2H2(g)+O2(g)△H2
2H2(g)+O2(g)△H2
以上反应的△H1_____________△H2 (选填“>"、“<”或“=”)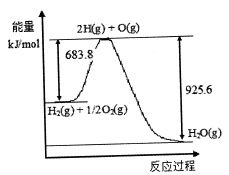
(3)已知H2 O(1)→H2 O(g)△H=" +44" mol·L-1,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式________________________________。
(4)氢能利用需要选择合适的储氢材料
①镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是__________________。
LaNi5H6(s)△H<0,欲使LaNi5H6 (s)释放出气态氢,根据平衡移动原理,可改变的条件之一是__________________。
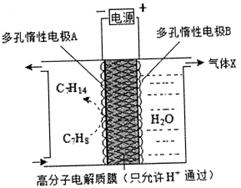
②一定条件下,如图所示装置可实现有机物的电化学储氢,总反应:2C7 H8+6 H2O(1) 2C7 H14+3O2 (g),电解过程中产生的气体X为_____,电极A发生的电极反应式为_________________。
2C7 H14+3O2 (g),电解过程中产生的气体X为_____,电极A发生的电极反应式为_________________。
湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程。
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________。
(2)浸出液以硫酸锌为主,还含有Fe3+、Fe2+、A13+、Cu2+、Cd2+、C1一等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为______________________。
②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的试剂为_____(填字母)
| A.NaOH | B.NH3·H2 O | C.ZnO | D.H2 SO4 |
③用Zn除去Cu2+和Cd2+
④用Ag2SO4除去Cl一,发生的反应为Ag2SO4+2Cl一 2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
(3)控制一定条件,用惰性电极电解硫酸锌溶液制取锌,锌在____极析出,阳极反应式为__________。
Ⅰ.M、A、B、C、D、E均为短周期主族元素,A的最外层电子数是M的4倍,A、B、C、D、E、F在周期表中位置如图所示。(请用化学用语作答)
| A |
B |
C |
D |
| E |
F |
(1)A在周期表中的位置。
(2)D、E、F三种元素形成的简单离子半径由大到小的顺序为。
(3)由M、B、C三种元素以原子个数比4:2:3形成化合物Q,Q中所含化学键类型有。检验该化合物中阳离子的方法是。(用离子方程式表示)。
(4)B与C可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有。
①酸雨②温室效应 ③光化学烟雾 ④臭氧层破坏
Ⅱ.一定条件下,2X(g)+Y(g) 2Z(g)+W(s)。
2Z(g)+W(s)。
(5)若反应在恒容绝热(不与外界交换能量)条件下进行,按下表数据投料,反应达到平衡状态,测得体系压强升高。
| 物质 |
X |
Y |
Z |
W |
| 起始投料/ mol |
2 |
1 |
2 |
0 |
升高温度,该反应平衡常数将_______(填“增大”“减小”或“不变”)。
(6)若反应在恒温、容积可变的密闭容器中进行,通过压缩容器体积改变压强,分别测得Y的平衡浓度如下表:
| 实验序号 |
① |
② |
③ |
| 压强p/Pa |
1×105 |
2×105 |
1×106 |
| c(Y)/mol·L-1 |
0.08 |
0.12 |
0.68 |
当压强为1×106 Pa时,此反应的平衡常数表达式为。
有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式。
(2)写出单质Z与元素Y的最高价氧化物对应的水化物(稀溶液,过量)反应的离子方程式。
Ⅱ.若X的简单离子半径是第三周期元素简单离子半径最小的。
(3)在定向爆破中,常利用氧化铁和单质X反应放出的热量来切割钢筋。该反应的化学方程式为。
(4)已知X的阳极氧化是一种常用的金属表面处理技术,它能使X的表面形成致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该处理过程,装置如图所示,该阳极的电极反应式为。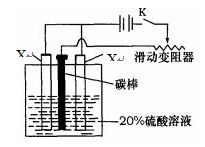
Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(5)化合物A溶于水后的变化(用离子方程式表示)。查阅资料发现,加入下列物质中的可提高A在水中的稳定性。
| A.Na2CO3 | B.KSCN | C.NH4NO3 | D.KOH |
以钛酸亚铁(FeTiO3)为原料制取BaTiO3的过程如下图所示:
(1)FeTiO3与稀硫酸反应,产物有TiOSO4、H2O和(填化学式)。
(2)已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O (l) △H=akJ·mol-1
H2TiO3(s)=TiO2(s)+H2O (l) △H=b kJ·mol-1
写出TiOSO4水解生成H2TiO3的热化学方程式。
(3)写出TiO2生成BaTiO3的化学方程式。