下表为硝酸钾在不同温度下的溶解度:
| 温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
| 溶解度(g) |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
(1)硝酸钾的溶解随温度的升高而 (填“增大”或“减小”)
(2)在20℃时,向100g水中加入120g硝酸钾固体,充分混合后所得溶液为 (填
“饱和”或“不饱和”)溶液;将其温度升高至60℃(不考虑溶剂的变化),则该溶液中溶质的质量分数为 (精确到0.1%)。
欲配制180 g溶质质量分数为50%的硝酸铵,实验操作如下图所示。
请回答下列问题:
(1)量取所需要的水应选择(选填“50mL”、“100mL”或“200mL”)量筒。
(2)用托盘天平称量所需的硝酸铵时,发现托盘天平的指针偏向左盘,应(选填序号)
A.增加适量硝酸铵固体 B.减少适量硝酸铵固体 C.调节平衡螺母
(3)将硝酸铵和水依次倒入烧杯中,要用玻璃棒搅拌,其目的是。
(4)用上述图示的序号表示配制溶液的操作顺序:。
(5)在做⑤操作时,烧杯的温度(选填“升高”或“降低”)了。
向分别装有50g水的A、B、C烧杯中加入10g、20g、30g的KNO3固体,充分溶解后,现象如图一所示: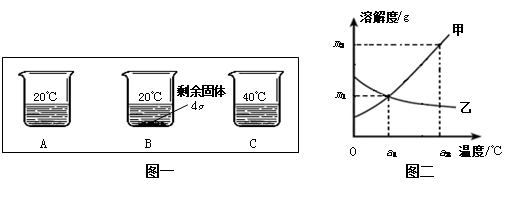
(1)A、B、C烧杯中溶液一定属于饱和溶液的是_______(选填序号)。
(2)图二中(选填“甲”或“乙”)能表示KNO3溶解度曲线。
(3)KNO3在20℃时溶解度等于。
(4)要使B烧杯中剩余固体继续溶解,可采用的方法是_________________________;
(5)由图二分析,若分别将甲、乙100g的饱和溶液从a2℃降温到a1℃,无晶体析出的是(选填“甲”、 “乙”或“甲和乙”),比较降温后所得溶液中溶质的质量分数甲乙(选填“>”或“<”或“=”)
(6)若要使a1℃时含100g水的甲的饱和溶液变为a2℃的饱和溶液(溶剂的量不减少),应采取的措施为(请依据图示作定量描述)。
某酒精溶液中乙醇所含的氢原子数与水所含的氢原子数相等,则该酒精溶液中溶质的质量分数为。
目前,我们国家的能源主要依赖于化石燃料,它们属于不可再生资源。因此,开发利用新能源就显得格外重要。
(1)常见的三种化石燃料包括石油、天然气和。
(2)美国墨西哥湾石油钻井平台爆炸,大量石油泄漏燃烧造成严重的污染,开发公司采用堵塞油管、喷水的方法灭火,其中喷水灭火的原理是。
从H、C、O 、S四种元素中选择恰当的元素,组成符合下列要求的物质,并将其名称填写在相对应的位置上。
(1)最常用的溶剂:;
(2)做干电池中的电极:;
(3)煤燃烧时排放的可形成酸雨的污染物:。