一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu—2e—====Cu2+;还原反应 2Fe3++2e—====2Fe2+(或Fe3++e—====Fe2+)。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3—+NO拆分成两个“半反应式”:氧化反应式 ;还原反应式 。
(2)已知某一反应的“半反应式”为CH4+10OH——8e—====CO32—+7H2O;O2+2H2O+4e—
====4OH—,则总反应式为 。
写出下列反应的离子方程式
(1)过氧化钠与水;
(2)金属铝与稀硫酸溶液;
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液;
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A),
(B)。
有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11)水溶液 ⑦酒精(C2H5OH)⑧熔化K2SO4⑨纯水。请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是______________
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。写出该反应
并配平
(2)上述反应中的氧化剂是,反应产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:
3As2S3+ 10H++ 28NO3—+ 4H2O=6H3AsO4+9SO42—+28NO↑
若生成2mol H3AsO4,则反应中转移电子的物质的量为mol。若将该反应设计成一原电池,则NO应该在(填“正极”或“负极”)附近逸出。
A、B、C、D、E、F、G是七种短周期主族元素,它们的原子序数依次增大,其中在元素周期表中A的原子半径最小,B和F、C和G分别是同一主族元素,含有D元素的物质焰色反应为黄色,G元素的最外层电子数是次外层电子数的3/4。又知B元素的最外层电子数是内层电子数的2倍,D、E、G三者的最高价氧化物的水化物两两皆能反应。请回答:
(1)A与C形成的原子个数比为1:1的化合物的电子式为,该物质含
键;它与GC2反应的化学方程式为
(2)D、E两者氧化物的水化物反应的离子方程式为;
(3)B、F的最高价氧化物(填化学式)的沸点高,理由是
(4)A、C、G间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为。
广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图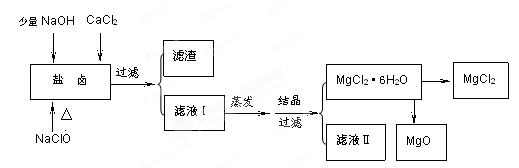
(1)滤液Ⅱ中所含主要的杂质离子是(写离子符号)。
(2) 加入NaClO的作用是。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是。