(8分)写出下列各种烃的结构简式
(1) 2,3,3-三甲基戊烷 ________________________ ;
(2)2,3-二甲基-4-乙基已烷 _________________ _____;
(3)间二甲苯_________________ _____;
(4)2-甲基-2-丁烯_________________ _____;
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下,钛不和非金属、强酸反应;红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一称金红石(TiO2)目前大规模生产钛的方法是:
第一步:金红石、碳粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式是______________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)此反应的化学方程式是__________________。
(2)简述由上述所得产物中获取金属钛的步骤______________。
如图所示: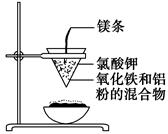
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
钛是一种活泼金属,具有密度小、熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用以冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O=H2TiO3↓+H2SO4
③H2TiO3 TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2 TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
(1)针对以上五个反应,下列叙述错误的是________。
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
(2)钛具有很强的耐腐蚀性,以下对其原因的分析正确的是________。
A.钛是像金、铂一样的不活泼金属
B.金属钛的表面易形成致密的氧化膜
C.钛与氧气、酸等腐蚀剂不反应
D.钛有很高的强度
铁是地壳中含量很丰富的元素,金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参与的两个反应的化学方程式:
___________________________。
(2)写出赤铁矿被CO还原成铁的化学方程式:________________。
(3)实验室中可用CO还原Fe2O3,在加热Fe2O3前应________,直到无________现象时才能点燃酒精灯加热,否则可能发生________现象,未反应完全的CO________(填“能”或“不能”)排放到大气中,应做________处理。
糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。
(1)蛋白质、淀粉、脂肪三种营养物质中水解的最终产物能与新制Cu(OH)2悬浊液反应的是________,制造肥皂的主要原料是________。
(2)蛋白质水解的最终产物是____________。
(3)下列有关说法中正确的是____________。
A.蛋白质中只含C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.糖类并不都有甜味
D.糖类、油脂、蛋白质都能发生水解反应
(4)淀粉溶液和蛋白质溶液都是胶体,用一束光通过其溶液,都产生____________,若检验它们可选用的试剂是____________。