随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示: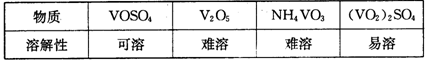
该工艺的主要流程如下:
请回答下列问题。
⑴工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为 。
⑵反应①的目的是 。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式: 。
⑷用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。
X为 (写化学式)。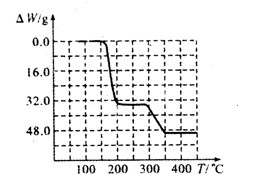
⑸经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如上图所示。则NH4VO3在分解过程中 (填序号)。
| A.先分解失去H2O,再分解失去NH3 | B.先分解失去NH3,再分解失去H2O |
| C.同时分解失去H2O和NH3 | D.同时分解失去H2、N2和H2O |
(12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是_______
(2)X与W组成的化合物中存在_______键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为____________________________________________________ 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式_________________________________________
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:
____________________________________________________ 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
B.B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为______________ 。
② 已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mLKMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式____________________________________________________。
(8分)已知A、B、C、D是中学化学中常见的四种不同粒子 .它们之间存在如下图所示的转化关系:
.它们之间存在如下图所示的转化关系: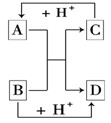
(1)如果A、B、C、D均是10电子的粒子,请写出:
A的结构式_______; D的电子式_______;
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,
请写出:
①A与B在溶液中反应的离子方程式 :
:
________________________________________________________
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
(8分) (1)1971年美国的斯图杰尔和阿佩里曼在0℃ 以下将氟气从细冰末上通过,成功地合成了一直认为不存在的氟的含氧酸——次氟酸。
①写出次氟酸的结构并标出各元素的化合价__________________;
②次氟酸刹那间被热水分解得到既可表现氧化性(对NaI)又可表现还原性(对KMnO4)的溶液,写出次氟酸分解 反应的化学方程式:____________________________。
反应的化学方程式:____________________________。
(2) 氰(CN)2的化学性质与卤素(X2)很相似称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
①HCN分子中含有4个共价键,写出HCN的结构式:_______ ;
②下列有关方程式不正确的是____________。
A. (CN)2+2NaOH===NaCN+NaCNO+H2O (CN)2+2NaOH===NaCN+NaCNO+H2O |
|
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O | C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
(10分)类推法是科学学习的重要方法之一
(1)下列类推结论正确的是:
| 类比对象 |
结论 |
|
| A |
Cl2+H2O HCl+H HCl+H ClO ClO |
I2+H2O HI+HIO HI+HIO |
| B |
C+2CuO  2Cu+CO2↑ 2Cu+CO2↑ |
C+SiO2  Si+ CO2↑ Si+ CO2↑ |
| C |
Na2O+H2O ="=" 2NaOH |
CuO+H2O ="=" Cu(OH)2 |
| D |
Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO |
Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
(2)在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质.请结合元素周期律完成下列问题:
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
450 |
|
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2 反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
①硒的熔点范围可能是_______ ;②碲的化合价可能有_______ ;
③硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式);
④氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为___________________________________。
(8分)通过简单地推理或计算填空:
(1)X原子有两个电子层,它能与最活泼的金属Y形成Y3X的化合物,X是_______元素(写元素符号)。
(2)若某元素原子的电子层数和Na原子的相同,最外层电子数与F原子相同,则该元素的原子序数是_______。
(3)6C元素能够与某非金属元素R形成化合物CRn,已知CRx分子中各原子核外最外层电子总数为32,核外电子数总和为74。则R是_______元素(写元素符号),n=_______。
(4)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D |
其氢氧化物和氧化物都有两性,与C同周期 |
| E |
与C同周期,原子半径在该周期最小 |
①写出E单质与A、B、C形成的化合物反应的化学方程式: ____________.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:____________.