美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图: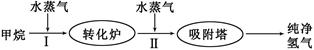
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是
| 实验编号 |
反应物投入量 |
平衡时H2浓度 |
吸收或放出的热量 |
反应物转化率 |
| A |
1、1、0、0 |
c1 |
Q1 |
α1 |
| B |
0、0、2、2 |
c2 |
Q2 |
α2 |
| C |
2、2、0、0 |
c3 |
Q3 |
α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 ="1"
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、
(写出两种)。若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。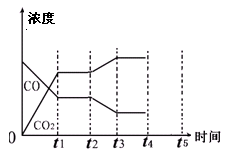
“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101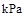 时:
时: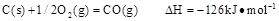
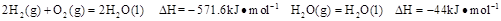
则在25℃,101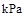 时:
时: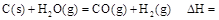 .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为: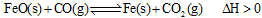 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,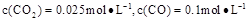 ,在这种情况下,该反应是否处于化学平衡状态?(填“是”或“否”),其判断依据是。
,在这种情况下,该反应是否处于化学平衡状态?(填“是”或“否”),其判断依据是。
③目前工业上可用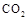 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为: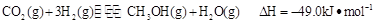 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol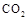 和3mol
和3mol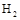 ,反应过程中测得
,反应过程中测得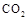 和
和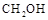 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。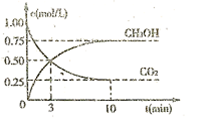
①从反应开始到平衡,氢气的平均反应速率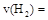 ;
;
②下列措施能使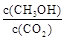 增大的是(填符号)。
增大的是(填符号)。
| A.升高温度 |
B.再充入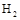 |
C.再充入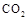 |
D.将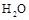 (g)从体系中分离 (g)从体系中分离 |
E.充入He(g),使体系压强增大
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: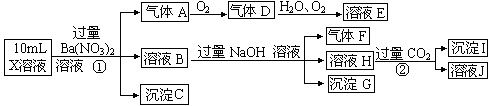
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子是___________,若要验证该离子是否存在,最可靠的化学方法是_______________________
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:
①中生成A________________________。
②_________。
(13分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电于数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若于种化合物。请回答:
(l)B元素的名称是。在周期表中的位置是。
(2)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)。
以下三种说法中,可以验证该结论的是(填写编号) 。
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
(4)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为 。
。
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。
①②③④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率(填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时,;
(3)可通过反应Fe3+ + SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K=。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K=。
.(18分)A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略 去)
去)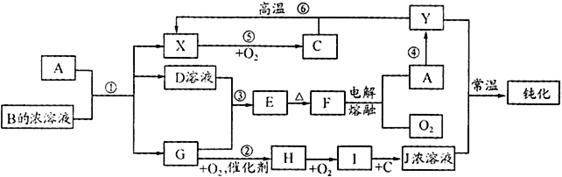
请填写下列空白:
(1)B的电子式为;
(2)D固体可用于净水,请用相应的离子方程式及简单文字说明原因:
;
(3)反应⑥的化学方程式为;
反应④在冶金工业上属于(填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为;
(5)反应②的化学方程式为;
反应③的离子方程式为;
(6)收集一试管H,将其倒置于水槽中,然后向试管中通入一定量的O2使试管内液面上升,最终剩余气体占试管容积的一半,则原有H与所通入O2的体积比为。