(10分)写出下列各有机物的结构简式:
(1)当0.2 mol烃A在氧气中完全燃烧时生成CO2和H2O各1.2 mol,催化加氢后生成2,2-二甲基丁烷,则A的结构式为___________。
(2)分子式为C6H12的某烯烃的所有的碳原子都在同一平面上,则该烯烃的结构简式为______________________。
(3)某烷烃A蒸气密度是相同状况下氢气密度的64倍,经测定知A分子中共含6个甲基。
①若A不可能是烯烃与氢气加成的产物,A的结构简式为______________________。
②若A是炔烃与氢气加成的产物,A的结构简式为______________________。
(4)某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基,且有三种不同环境的氢原子,请写出其结构简式_____________________.
(1)现有以下物质:①NaCl溶液;②液态SO3;③乙醇(C2H5OH);
④熔融的KNO3;⑤BaSO4固体;⑥干冰;Cu
其中:属于电解质的是(用序号填写)
(2)已知铜在加热条件下能与浓H2SO4反应,产物为CuSO4、SO2、H2O,写出该反
应的化学方程式__________________,其中发生氧化反应的物质是______。
25℃时0.1 mol/L的醋酸溶液pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L 的醋酸溶液中加入少量下列物质中的(填写编号),然后测定溶液的pH(已知25℃时,CH3COONH4溶液呈中性)
| A.固体CH3COOK | B.固体CH3COONH4 | C.气体NH3 | D.固体NaHCO3 |
(2)若的解释正确,(填甲或乙),溶液的pH应(填增大、减小或不变)。
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有种粒子;
②其中有两种粒子的物质的量之和一定等于0.010mol,它们是和。
某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW=。在此温度下,将 pH = a的 NaOH 溶液 Va L 与 pH = b的 H2SO4溶液 Vb L 混合。
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb=;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb=;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb=。
如图所示,容器A左侧是无摩擦、可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答: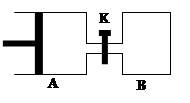
(1)A中X的转化率为。
(2)平衡时,A、B中X转化率大小关系为AB(选填“>”、“<”、“="”" )
一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 (填“增大”、 “减小”或“不变”),化学平衡(填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ,化学平衡。