右图表示4-溴环己烯所发生的4个不同反应。其中,产物官能团种类不会减少的反应是( )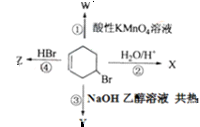
| A.②③ | B.③④ |
| C.①② | D.①④ |
漂白粉的有效成分是
| A.氯化钙 | B.次氯酸钙 |
| C.次氯酸 | D.次氯酸钙与氯化钙 |
下列叙述正确的是
| A.与28gCO具有相同分子数的CO2的质量一定是44g |
| B.与VLCO具有相同分子数的CO2的体积一定是VL |
| C.所含原子数相等的CO与CO2的密度之比为7∶11 |
| D.所含原子数相等的CO与CO2的密度之比为21∶22 |
实验室配制1mol/L 250mL NaCl溶液,下列仪器中不需要的是
| A.玻璃棒 | B.250mL容量瓶 | C.胶头滴管 | D.分液漏斗 |
能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| ① |
H2(g)+ O2(g)= H2O(g) △H =﹣242kJ /mol; O2(g)= H2O(g) △H =﹣242kJ /mol; |
|||||||
| ② |
2H2(g)+ O2(g)= 2H2O(l) △H=﹣572kJ/mol; |
|||||||
| ③ |
C(s)+ O2(g)= CO(g) △H=﹣110.5kJ/moL; O2(g)= CO(g) △H=﹣110.5kJ/moL; |
|||||||
| ④ |
C(s)+ O2(g)= CO2(g) △H=﹣393.5kJ/moL; |
|||||||
| ⑤ |
CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H=" +" 802kJ/moL |
|||||||
| 化学键 |
O=O |
C-C |
H-H |
O-O |
C-O |
O-H |
C-H |
|
| 键能kJ/mol |
497 |
348 |
436 |
142 |
351 |
463 |
414 |
|
则下列说法正确的是
A.H2燃烧热的热化学方程式为H2(g)+ O2(g)= H2O(g) △H =﹣242kJ /mol
O2(g)= H2O(g) △H =﹣242kJ /mol
B.热化学方程式:C(s)+ H2O(g) H2(g)+ CO(g) △H =" +" 175.5 kJ/moL
H2(g)+ CO(g) △H =" +" 175.5 kJ/moL
C.CH4的燃烧热△H ="—" 802 kJ/moL
D.估算出C=O键能为800kJ/moL
A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小。下列叙述错误的是
A.元素C位于周期表中第三周期ⅢA族
B.熔融电解化合物CE3可制取单质C
C.D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物
D.化合物B2D2中既含离子键又含非极性共价键