实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
已知烧瓶内发生的是制取氯气的反应:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O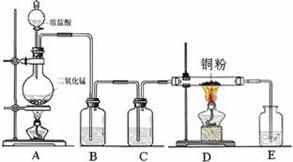
(1)用双线桥法标出烧瓶内发生反应的电子转移方向和数目
MnO2+4HCl(浓) 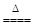 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)B处盛有饱和食盐水,其作用是 。
(3)C处盛放的是下列试剂中的_______(填序号);E处盛放的是下列试剂中的______(填序号),发生反应的离子方程式为 。
a、水 b、氢氧化钠溶液 c、浓硫酸 d、饱和食盐水
(4)有同学认为该装置存在缺陷,改进的方法是__________________________________。
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
催化剂 |
|
| ① |
10ml2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_ 。
(2)实验①和②的目的是__________________________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
分析上图能够得出的实验结论是。
(14分)
实验室用下图所示装置制备溴苯,并验证该反应是取代反应。 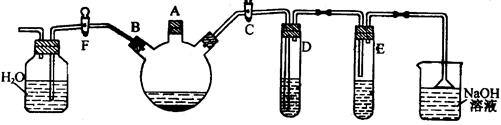
(1) 关闭F活塞,打开C活塞,在装有少量苯的三颈瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,则三颈瓶中发生反应的化学方程式为: 。
(2) D试管内装的是 ,其作用是 。
(3) E试管内装的是 ,E试管内出现的现象为 。
(4) 待三口烧瓶中的反应即将结束时(此时气体明显减少),打开F活塞,关闭C活塞,可以看到的现象是 。
(5) 上一步得到粗溴苯后,要用如下操作精制:a蒸馏; b水洗; c用干燥剂干燥; d 10%NaOH溶液洗涤; e水洗,正确的操作顺序是 。
已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
限选的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
(一)初步探究
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)上述实验可以得到的初步结论是
。
(二)进一步探究
(2)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
| 实验操作 |
预期现象和结论 |
(10分)化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了下图所示的装置进行实验。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。
 试回答下列问题:
试回答下列问题: (1)请你完成装置改进的措施和理由:
(1)请你完成装置改进的措施和理由: ①措施:在A、B之间加一个干燥管,
①措施:在A、B之间加一个干燥管, 理由_______________________________________。
理由_______________________________________。 ②措施: ________________________,
②措施: ________________________, 理由______________________________________。
理由______________________________________。 (2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是
(2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是 _______________________ (用化学方程式表示)。
_______________________ (用化学方程式表示)。 任何的推论都要经过检验,请完成对白色固体成分的探究:
任何的推论都要经过检验,请完成对白色固体成分的探究: 限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液、澄清石灰水、品红溶液。
① 提出合理假设:
提出合理假设: 假设1:白色固体为Na2SO3;假设2:白色固体为Na2SO3与Na2SO4的混合物;
假设1:白色固体为Na2SO3;假设2:白色固体为Na2SO3与Na2SO4的混合物; 假设3: 。
假设3: 。
② 设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| … |
(10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答:
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
| 成分 |
|||
| 质量/g |
(2)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度___ __(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。