用氯气消毒过的自来水配制下列溶液时,会使配得的溶液变质的是
①NaOH ②AgNO3 ③Na2CO3 ④FeCl2
| A.②④ | B.①②③ | C.①③ | D.①②③④ |
30 mL 1 mol/L NaCl溶液和40 mL 0.5 mol/L CaCl2溶液混合之后(体积的变化忽略不计),混合液中Cl-的物质的量浓度为
| A.0.5 mol/L | B.0.6 mol/L | C.1 mol/L | D.2 mol/L |
在前一种分散系中慢慢滴加后一种试剂,能观察到先生成沉淀后变澄清的是
①氯化铝溶液中滴加氢氧化钠溶液②偏铝酸钠溶液中加盐酸③氢氧化钠溶液中滴加氯化铝溶液④蛋白质溶液中滴入硫酸铜溶液⑤氯化铝溶液中滴加氨水⑥硝酸银溶液中滴加氨水⑦氢氧化铁胶体中滴加硫酸
| A.①②⑥⑦ | B.②③⑤⑦ | C.①②④⑥ | D.③④⑤⑥ |
2008年4月20日中国新闻网报道,文物界专家认为,“南海一号”价值不亚于兵马俑。从宋代商船“南海一号”中打捞出的金、银、铜、铁、瓷类文物共4 000余件。下列有关说法不正确的是
| A.出水的大量瓷器为传统的硅酸盐产品 |
| B.除去瓷类器件表面污垢可以选用热烧碱溶液 |
| C.随船沉浸在海水中的铜、银等古钱币和铁制品,以铁制品被腐蚀的最厉害 |
| D.金、银、铜、铁都能溶于硝酸 |
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现:
①Si(s)+3HCl(g) SiHCl3(g)+H2(g);ΔH="-381" kJ·mol-1
SiHCl3(g)+H2(g);ΔH="-381" kJ·mol-1
②SiHCl3+H2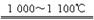 Si+3HCl对上述两个反应的叙述中,错误的是
Si+3HCl对上述两个反应的叙述中,错误的是
| A.两个反应都是置换反应 | B.反应②是吸热反应 |
| C.两个反应互为可逆反应 | D.两个反应都是氧化还原反应 |
向某NaOH溶液中通人CO2气体后得溶液M,因CO2通人量的不同,溶液M的组成也不同。若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加人盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断一定正确的是(不计CO2的溶解)
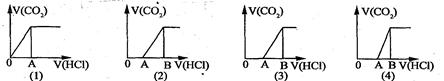
| A.(1)图显示M中只有一种溶质且为Na2CO3 |
| B.(3)图显示M中有两种溶质且为Na2CO3、NaOH |
| C.(2)图显示M中有两种溶质且为Na2CO3、NaHCO3 |
| D.(4)图显示M中c(NaHCO3)=c(Na2CO3) |