已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①硫酸溶液 |
②硫酸氢钠溶液 |
③醋酸溶液 |
④盐酸 |
HSO4-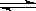 H++SO42— H++SO42— |
HSO4-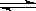 H++SO42- H++SO42- |
CH3COOH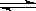 CH3COO-+H+ CH3COO-+H+ |
HCl = H++Cl- |
| 10℅ |
29℅ |
1.33℅ |
100℅ |
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
有机物A的结构简式如右图:
⑴、A与过量NaOH完全反应时,A与参加反应的NaOH物质的量的比为.
⑵、A与新制的Cu(OH)2完全反应时,A与参加反应的Cu(OH)2的物质的量的比为
其中A与被还原的Cu(OH)2的物质的量的比为
⑶、A与过量的NaHCO3完全时,A与参加反应的NaHCO3的物质的量的比为。
某种高强度纤维由三种单体合成,结构为:
则这三种单体的结构简式为_____________、 _____________、。
将铜片投入盛有稀硫酸的试管中无反应。当加入少量硝酸钾晶体后,试管内产生一种无色气体,这种气体在试管口变成红棕色。这种无色气体是__________。写出有关的离子反应方程式.________________________________________________________
将Cu片放入0.1mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3; ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |