下表为元素周期表的一部分,请回答有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨[ |
|
|
|
|
|
⑩ |
|
(1) ⑤和⑧的元素符号是_________和_________.
(2) 此表中最活泼的金属是_ __(填写元素符号),非金属性最强的元素是_ _(填写元素符号).
(3)在 ③ ~ ⑦ 元素中,原子半径最大的是 (填写元素符号)。
(4)表中能形成两性氢氧化物的元素是_________(填写元素符号),分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:
________ 、 ________。
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。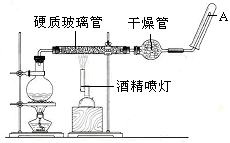
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式:;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
| ① |
② |
③ |
④ |
|
| 溶液中的金属离子 |
Fe2+ |
|||
| 残留固体成分 |
Fe、Pt |
Pt |
Pt |
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a =,b =,
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因;
溶液中离子浓度由大到小的顺序为
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a |
|||||||||||||||||
| b |
c |
d |
|||||||||||||||
| e |
f |
g |
h |
i |
|||||||||||||
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为,它与e的最高价氧化物对应水化物反应的离子方程式为。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为它与h的低价态氧化物反应的化学方程式为。
某研究性学习小组在网上收集到如下信息:硫化钠,俗称臭碱,是一种强还原剂,在工业上用途广泛。他们对硫化钠与次氯酸钠的反应进行探究。
【实验】
在次氯酸钠溶液中加入硫化钠溶液,发现溶液始终澄清。
(1)下列有关硫化钠的说法正确的是。
a. 硫化钠溶液不宜久置,应现用现配
b. 硫化钠溶液中通入SO2有淡黄色浑浊,可证明SO2有氧化性
c. 硫化钠在空气中潮解并不断放出H2S气体,说明酸性:H2CO3>H2S
d. 配制硫化钠溶液时加入少量氢氧化钾
e. 向硫化钠溶液中滴加稀硝酸有臭鸡蛋气味的气体生成
【提出假设】
(2)反应后的溶液中肯定存在Cl-、SO42-和OH-,为探究溶液中可能还存在的其他阴离子(不考虑离子水解及空气中CO2的影响),该学习小组提出如下假设:
假设1:只还存在S2-
假设2:只还存在ClO-
假设3:
【设计实验方案,验证假设】
(3)请写出实验步骤以及预期现象和结论。
限选实验试剂:1 mol• L-1的CuSO4溶液、1 mol• L-1NaOH溶液、淀粉-KI溶液、紫色石蕊试液、酚酞试液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少许反应后溶液于试管中,滴加 |
若,则假设成立。 |
| 步骤:2:另取少许反应后溶液于试管中,滴加 |
若,则假设成立。 若 , 则假设3成立。 |
【思考与交流】
(4)实验时某同学发现所用硫化钠溶液呈黄色,联想到工业盐酸呈黄色的原因,该同学认为所用硫化钠溶液中混有少量FeCl3。你是否同意该同学的的观点(填“同意”或“不同意”),请简述理由:。
六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主成分为SrSO4)为原料制备,生产流程如下:
(1)第①步反应前天青石先研磨粉碎,其目的是________________。
第③步加入适量稀硫酸的目的是_______。
(2)第①步反应若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:________________________________________。
(3)第④步操作依次是蒸发浓缩、冷却结晶、过滤、________、_______。
(4)称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(产品中不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。若滴定过程用去上述浓度的KSCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为________(保留4位有效数字)。