【化学—选修5:有机化学基础】
A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。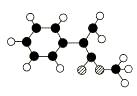
Ⅰ.根据分子结构模型写出A的分子式 ,A的核磁共振氢谱有_______个吸收峰。
Ⅱ.以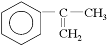 为主要原料合成A的路线如下:
为主要原料合成A的路线如下: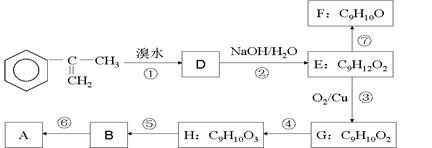
(1)下列反应的反应类型:④ ⑥ ;
(2)H的结构简式为___________ ,B中官能团的名称为 ;
(3)写出反应②的化学方程式(注明必要的条件)
(4)已知烯醇式不稳定,会转化为醛:R—CH="CH—OH" → R—CH2—CHO。反应⑦生成的有机物有两种可能,它们的结构简式分别为 、 ,要把它们区别开来,可使用的试剂是 。
以下物质:①NH3 ②BaCO3固体 ③酒精 ④盐酸 ⑤Cu ⑥NaCl晶体 ⑦纯醋酸
能导电的是(填编号,下同),属于电解质的有。
(2)9g H2O分子所含氢原子数与 L CH4(标准状况下)所含氢原子数相等;
(3)同温同压下,0.6mol O2与9.6g O3的原子个数比为,体积比为。
(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
①在反应体系中加入催化剂,反应速率,该反应的反应热(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=,H2的转化率为(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是。
| A.把气体的体积压缩至1L | B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a0。(填“大于”、“小于”或“等于”)
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和液态水,放出327.04kJ的热量。
(1)写出该反应的热化学方程式___________________________________。
(2)已知H2O(l)==H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和气态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
如图所示,K1固定不动,K2可自由移动,A、B两个容器中均发生反应:X(g) + 3Y(g)  2Z(g) ΔH=-92kJ•mol-1。若向A、B中都通入xmolX和ymolY的混合气体,且初始A、B容积相同,假设整个过程中A、B均保持温度不变。请回答:
2Z(g) ΔH=-92kJ•mol-1。若向A、B中都通入xmolX和ymolY的混合气体,且初始A、B容积相同,假设整个过程中A、B均保持温度不变。请回答: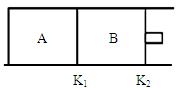
(1)若x=1,y=3,起始容积均为1L,在某温度下,5min后A中达到化学平衡状态,测得X还剩0.2mol,则5min内Y的反应速率;
(2)若x:y=1:2,则平衡时,A容器中的转化率:XY(请填“>”,“<”,“=”);
(3)若x=1,y=3,某温度下,当B中放出热量78.2kJ时,则B中X的转化率为;
(4)若A起始容积为2L,x=0.20mol,y=0.60mol,反应中Z的物质的量浓度的变化情况如下图所示,且在第5分钟时移动K1使A容器的体积瞬间缩小一半后,若在第7分钟时达到新的平衡(此时Z的浓度约为0.25 mol·L—1 ),请在图中画出第5分钟后Z浓度的变化曲线。
现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____________。
(2)④、⑤、⑥、⑦四种溶液中 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是________。
(4)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”) ________25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。