海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
Na+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
S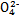 |
HC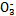 |
| 含量/(mg·L-1) |
9 360 |
83 |
200 |
1 100 |
16 000 |
1 200 |
118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol·L-1。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。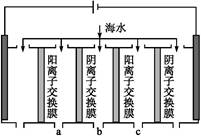
电渗析原理示意图
①阴极的电极反应为 。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式: 。
③淡水的出口为a、b、c中的 出口。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 5.00%的
5.00%的 溶液、足量的
溶液、足量的 溶液和l00
溶液和l00 10.00%的
10.00%的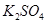 溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中
溶液.电极均为石墨电极。接通电源,经过一段时间后,测得丙中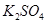 浓度为10.47%,乙中c电极质量增加。据此回答问题:
浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③电极b上生成的气体在标准状况下的体积: ;④电极c的质量变化是  ;
;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(每空3分)碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g) WI2(g)ΔH<0
WI2(g)ΔH<0
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为。
(2)能够说明上述反应已经达到平衡状态的有。
| A.I2与WI2的浓度相等 |
| B.容器内气体压强不再变化 |
| C.W的质量不再变化 |
| D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等 |
E.容器内混合气体的密度保持不变
(3)下图为该反应在450℃时的时间—速率图,则t2时刻改变的外界条件可能是,若t4时刻将容器压缩至一半(各物质状态不变),保持该条件至t6,请在图中画出t4到t6时间段内大致曲线图,并在相应曲线上标上υ3(正)、υ3(逆)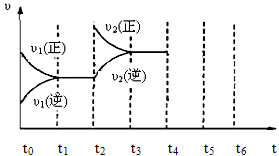
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g) CH3OH(g) ΔH,
CH3OH(g) ΔH,
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
①根据表中数据可判断ΔH0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将。
| A.向正方向移动 | B.向逆方向移动 | C.处于平衡状态 | D.无法判断 |
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH=-1451.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
。
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为,随着反应的不断进行溶液的pH(填“增大”“减小”或“不变”)。
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为mL(标况下)。
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈性,原因(用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
(15分)PET是世界上产量最大的合成纤维,其结构简式为:
现以煤的干馏产品A与F为原料制备PET,生产的工艺流程如图所示。其中A为烃,含碳元素的质量分数为90.6%,其蒸气密度是空气密度的3.66倍,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。
请回答下列问题:
(1)A的分子式为:________,下列反应类型为:M―→N________;反应⑤________。
(2)反应①的反应条件为:________;A的名称为________。
(3)写出有机物A所有一氯代物的结构简式:
________________________________________________________________________。
(4)写出下列反应的化学方程式:
反应③:_______________________________________________________________;
D与足量的氢氧化铜悬浊液煮沸:____________________________________________;
(5)P的一种同系物X的分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2∶1∶1。则X的结构简式为_________________。