实验室常用饱和NaNO2和NH4Cl溶液反应制取纯净的氮气。反应式为:
NaNO2 + NH4Cl ="=" NaCl + N2↑+2H2O↑,该反应过程中放热。实验如下图,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是:________
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.NaNO2饱和溶液容易滴下
(2)B部分的作用是_________
a.冷凝 b.冷却氮气 c.缓冲氮气流
(3)加热前必须进行一个操作步骤是: ;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是: 。
(4)收集N2最适宜的方法是________
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
电解原理在化学工业中有广泛应用。如下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
如下图在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体。接通电源,阳极周围的液体呈现棕色,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: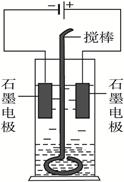
(1)阳极上的电极反应式为 。
(2)阴极上的电极反应式为 。
(3)原上层液体是 。
(4)原下层液体是 。
(5)搅拌后两层液体颜色发生变化的原因是 。
(6)要检验上层液体中含有的钾离子,其方法是 ,现象是 。
(10分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。完成下列问题: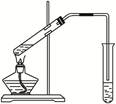
(1)写出制取乙酸乙酯的化学反应方程式__________________________________________。
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:________________。
(3)浓硫酸的作用是:①___________________________;②___________________________。
(4)饱和碳酸钠溶液的主要作用是
__________________________________________________。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
___________________________________________。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____________________________。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
______________________________________________________________________________。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) _________________。
①单位时间里,生成1 mol乙酸乙酯,同时生成1 mol水
②单位时间里,生成1 mol乙酸乙酯,同时生成1 mol乙酸
③单位时间里,消耗1 mol乙醇,同时消耗1 mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(8分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。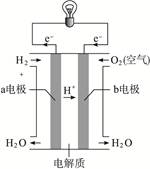
(1)氢气在燃烧时,放出大量热量,说明该反应是_________________热反应,这是由于反应物的总能量_________________生成物的总能量;从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量__________________________________________________形成产物的化学键放出的总能量。
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2 g氢气燃烧时放出286 kJ热量,而每千克汽油燃烧时放出的热量为46000 kJ。试据此分析氢气作为能源代替汽油的优势:_____________________________________________________________________________。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,右图就是能够实现该转化的装置,被称为氢氧燃料电池。该电池的正极是_________________ (填“a电极”或“b电极”),在负极发生的电极反应是_________________,电池反应为_________________。
(13分)下面是某学校研究化学反应中能量变化情况的实验:(氢氧化钡晶体与氯化铵晶体的反应)
下表是某学生根据上述实验方案和步骤列表整理的实验事实和结论:
| 实验步骤 |
实验现象 |
得出结论 |
| 将晶体混合后立即用玻璃棒快速搅拌混合物 |
有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝 |
|
| 用手触摸烧杯下部 |
感觉烧杯变凉 |
|
| 用手拿起烧杯 |
烧杯下面的带有几滴水的玻璃片(或小木板)粘到了烧杯底部 |
|
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起 |
玻璃片脱离上面烧杯底部 |
|
| 反应完后移走烧杯上的多孔塑料Q片,观察反应物 |
混合物成糊状 |
(1)请你根据实验现象得出相应的实验结论填入上表中。
(2)用化学方程式表示上述反应为_________________________________________________。