A、B、C三元素原子的核外电子数都比氩原子少, A和C处于同主族,两者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外第3电子层比第2电子层少两个电子,则B的原子结构示意图为______;A离子的结构示意图为_____;B与C形成化合物的化学式是_____,它的电子式是 它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 ,它的电子式是 ,它属于 化合物。
在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g);△H=" Q" KJ/mol其化学平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答:
(1)上述反应中Q0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是。
a. 容器中压强不变 b. 反应热不变 c. v正(H2) =v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内物质的浓度变化如下表:
850℃时物质的浓度(mol/L)的变化
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c 2 |
c 3 |
c 3 |
| 4 |
c 1 |
c 2 |
c 3 |
c 3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
①计算:3 min时CO的浓度c 1 =mol/L,H2O (g)的转化率=。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是表中5min~6min之间数值发生变化,可能的原因是
a . 增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气浓度
Ⅰ.某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
(2)恒定温度、压强
①若x = 0,y = 0,则z _________;
②x、y、z应满足的一般条件是_______________________________。
Ⅱ.将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)  2H2+O2、2CO+O2
2H2+O2、2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_____和_____,或____和_____。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为: n(O2)平=a mol,n(CO2)平=b mol。
试求n(H2O)平=__________。(用含a、b的代数式表示)
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: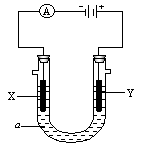
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是。在X极附近观察到的现象是。
②Y电极上的电极反应式是
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的电极反应式是
②Y电极的反应式是
(说明:杂质发生的电极反应不必写出)
(1)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(2)下列说法不正确的是__________。
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的; |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
E. 沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是___________________,且各离子的物质的量之比为___________________;肯定不含的阳离子是____________________。写出平行线段线所发生反应的离子方程式: