为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置: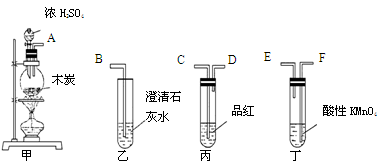
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中酸性KMnO4溶液的作用是 ;
(4)写出甲中反应的化学方程式 。
试回答下列中和热测定的有关问题。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50mol·L-1盐酸、0.55mol·L-1 NaOH溶液,尚缺少的实验用品是__________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒__________,其原因是______________________________________________。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=___________________________________。
A、B两种有机化合物,分子式都是C9H11O2N。
(1)化合物 A是天然蛋白质的水解产物,光谱测定显示:分子结构中不存在甲基(-CH3),化合物 A的结构简式是______。
(2)化合物B是某种分子式为C9H12的芳香烃一硝化后的唯一产物(硝基连在芳环上),化合物B的结构式是______。
写出五种你熟悉的不同类别的有机物结构简式,它们分别是各类物质中最简单且完全燃烧产生的CO2和H2O(g)的体积比均为V(CO2)∶V[H2O(g)]=1。
(1)______(2)______(3)______(4)______(5)______
已知:
2H2(气)+O2(气)=2H2O(气)+Q12H2(气)+O2(气)=2H2O(液)+Q2
2CO(气)+O2(气)=2CO2(气)+Q3
(1)关于Q1和Q2的关系正确的是______。
| A.Q1>Q2 | B.Q1<Q2 |
| C.Q1=Q2 | D.无法比较 |
你选择该答案的理由是______。
(2)CO和H2分别燃烧生成CO2和H2O(气),欲得到相同的热量,所需CO和H2的体积比是______。
已知气态氯化铝分子以双聚形式存在,其结构式如下图所示:
图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享,又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面这个方程式右端的两种离子的表达式: ______+______
______+______